Agonisty receptorov GLP1 a ateroskleróza
GLP-1 receptor agonists and atherosclerosis
Diabetes is one of the main modifiable risk factors of atherosclerotic cardiovascular disease and therefore it is important to consider in diabetes to use treatment with sufficient evidence on cardiovascular risk reduction. Based on its effect on cardiovascular risk GLP-1 RA is such a treatment option. The benefit can be partially explained by its effect on some conventional risk factors, effects on endothelial function, anti-inflammatory and antiatherogenic mechanisms have been also suggested.
Keywords:
diabetes – Atherosclerosis – GLP-1 RA
Autoři:
Branislav Vohnout 1,2,3; Jana Lisičanová 3
Působiště autorů:
Ústav výživy, Fakulta ošetrovateľstva a zdravotníckych odborných štúdií a Koordinačné centrum pre familiárne hyperlipoproteinémie, SZU, Bratislava
1; Ústav epidemiológie LF UK, Bratislava
2; Diabetologická ambulancia, Diabeda s. r. o., Bratislava
3
Vyšlo v časopise:
AtheroRev 2022; 7(2): 100-103
Kategorie:
Přehledové práce
Souhrn
Diabetes mellitus je jedným z hlavných ovplyvniteľných rizikových faktorov aterosklerotického kardiovaskulárneho ochorenia, a preto je v jeho liečbe nutné zvažovať použitie takej liečby, ktorá má dostatok evidencie pre zníženie kardiovaskulárneho rizika. Jednou z kľúčových skupín antidiabetík sa tak aj na základe svojho vplyvu na zníženie kardiovaskulárneho rizika stali agonisty GLP1-receptorov (GLP1-RA). Preukázaný benefit GLP1-RA možno vysvetliť vplyvom na niektoré konvenčné rizikové faktory, zdá sa však, že úlohu zohrávajú aj iné vlastnosti GLP1-RA, ako je ovplyvnenie funkcie endotelu, protizápalový a antiaterosklerotický efekt.
Klíčová slova:
ateroskleróza – diabetes mellitus – GLP1-RA
Úvod
Diabetes mellitus je jedným z najrýchlejšie rastúcich ochorení súčasnej doby a jeho výskyt a dynamika má alarmujúci charakter na celosvetovej úrovni. Týmto ochorením trpelo v roku 2021 viac ako pol miliardy ľudí na svete a do roku 2030 sa odhaduje, že toto číslo stúpne na 643 miliónov [1]. Prítomnosť ochorenia diabetes mellitus (DM) vo všeobecnosti predstavuje viac ako 2-násobné riziko aterosklerotických kardiovaskulárnych ochorení (ASKVO) – ischemická choroba srdca (ICHS), ischemická cievna mozgová príhoda (CMP) a kardiovaskulárne úmrtia, nezávisle od iných rizikových faktorov [2,3]. Toto zvýšené relatívne riziko vaskulárnych príhod spojené s DM je väčšie v mladšom veku a u žien. Navyše, prítomnosť diabetu spôsobuje, že ženy s DM nie sú chránené pred predčasným výskytom kardiovaskulárnych ochorení (KVO), tak ako tomu je u žien vo všeobecnej populácii [4,5].
Zvýšené kardiovaskulárne (KV) riziko u diabetikov je reflektované aj v súčasných guidelines [3]. Diabetici s orgánovým postihnutím alebo prítomnosť najmenej 3 veľkých rizikových faktorov (RF) spadajú do veľmi vysokého KV-rizika. Pacienti s DM bez orgánového poškodenia, s dobou trvania DM ≥10 rokov alebo s ďalším RF majú vysoké riziko a mladých pacientov (s DM 1. typu do veku 35 rokov a s DM 2. typu do veku 50 rokov) s trvaním diabetu < 10 rokov a bez ďalších RF zaraďujeme do kategórie stredného rizika. Správny manažment RF aterosklerózy teda logicky patrí k nutnosti v liečbe diabetikov. Na druhú stranu, výsledky klinických štúdií sledujúcich vplyv antidiabetík (s výnimkou metformínu) na KVO až do nedávnej minulosti neprinášali predpokladaný pozitívny efekt na redukciu tohto rizika, ktoré vychádzalo zo známych asociácií medzi KV-rizikom a hladinou glykémie. Významný posun sme zaznamenali v posledných rokoch, kedy klinické skúšanie s novými antidiabetikami, teda GLP1-receptorovými agonistami a inhibítory kotransportu SGLT2 prinieslo redukciu KV-rizika u pacientov s DM 2. typu (DM2T).
Agonisty GLP1-receptorov
Jednou z kľúčových skupín antidiabetík sa tak aj na základe svojho vplyvu na zníženie KV-rizika stali agonisty GLP1-receptorov (GLP1-RA). GLP1-RA majú inzulinotropný efekt – stimulujú sekréciu inzulínu v závislosti od nárastu glukózy v krvi, znižujú motilitu žalúdka, ovplyvňujú pocit sýtosti a znižujú hladinu glukagónu postprandiálne [6] a dokážu významne redukovať hladinu HbA1c až o 2 % [7].
Výsadné postavenie v liečbe DM2T im však priniesli výsledky klinických štúdií sledujúce vplyv na KV-riziko (tab. 1). Metaanalýza týchto štúdií preukázala 14 % (HR 0,86; 95% CI 0,79–0,94) redukciu klasických veľkých KV-sledovaných ukazovateľov (MACE – kardiovaskulárna mortalita, nefatálny infarkt myokardu a nefatálna cievna mozgová príhoda), s výraznejším efektom u pacientov s prítomným KVO (redukcia o 16 %) v porovnaní s pacientami bez známeho KVO (redukcia o 6 %) [8]. Väčšina štúdií však zahŕňala hlavne pacientov s KVO (72,4–100 % všetkých pacientov), 12 % signifikantný pokles rizika v štúdii REWIND s dulaglutidom, ktorá zahŕňala takmer 70 % bez známeho KVO a absencia signifikantnej heterogenity medzi pacientami s a bez známeho KVO naznačujú pozitívny efekt GLP1-RA pre obe skupiny pacientov s DM2T [8]. Metaanalýza tiež preukázala 13 % signifikantnú redukciu KV-mortality a 16 % signifikantnú redukciu nefatálnych cievnych mozgových príhod (CMP) a 9 % pokles nefatálnych infarktov myokardu (IM), tento však nedosiahol štatistickú signifikanciu. GLP1-RA taktiež významne redukovali riziko celkovej mortality (o 12 %), pričom celková mortalita bola redukovaná v 3 individuálnych štúdiach (LEADER s liraglutidom, EXSCEL s exenatidom a PIONEER 6 so semaglutidom). Liečba GLP1-RA priniesla tiež 10 % pokles rizika srdcového zlyhávania a 17 % redukciu kompozitného renálneho ukazovateľa v dôsledku 26 % redukcie makroalbuminúrie [8]. Preukázaný benefit GLP1-RA možno čiastočne vysvetliť vplyvom na hladinu HbA1c, tlak krvi a ostatné konvenčné rizikové faktory, zdá sa však, že úlohu zohrávajú aj iné vlastnosti GLP1-RA, ako je ovplyvnenie funkcie endotelu, mikrovaskulárneho systému, protizápalový, antifibrotický, antiaterosklerotický a vazodilatačný efekt [8]. Efekt GLP1-RA na aterosklerózu a aterosklerotické kardiovaskuárne riziko možno rozdeliť na priame a nepriame mechanizmy [9], tab. 2.
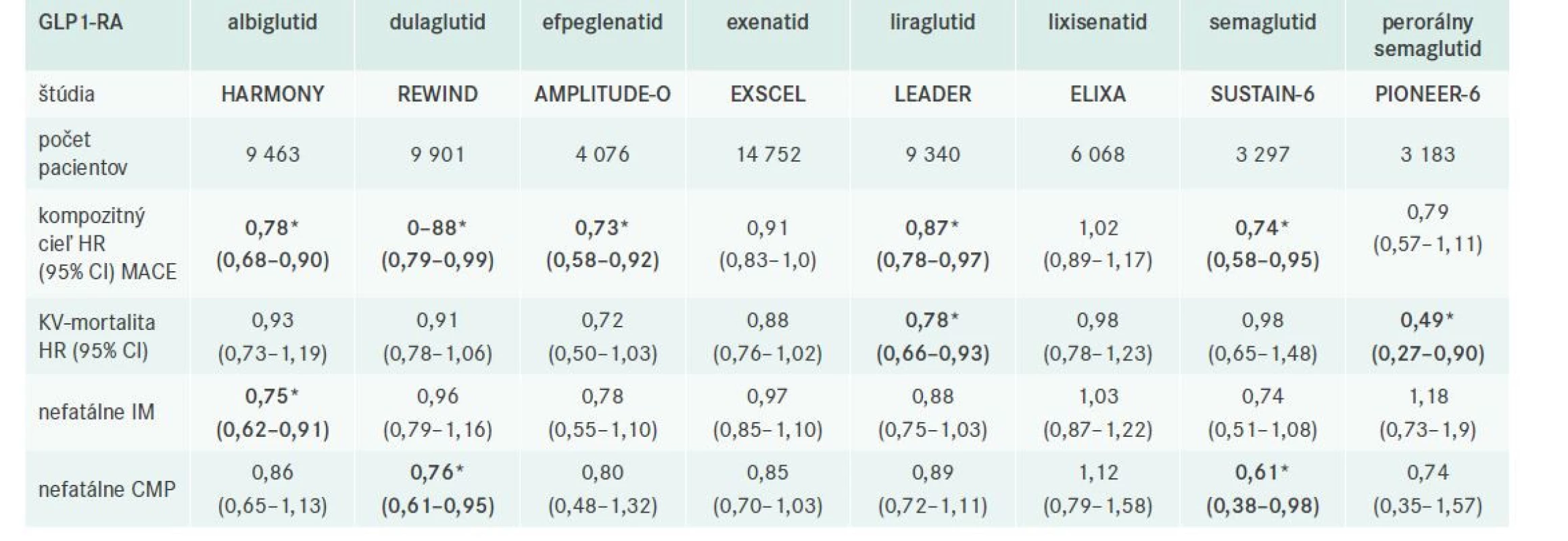
*hrubým písmom vyznačené signifikantné výsledky
![Priamy a nepriamy efekt GLP1-RA
na aterosklerózu. Upravené podľa [9]](https://www.atheroreview.eu/media/cache/resolve/media_object_image_small/media/image_pdf/423e02e1588c75bcca173601b48b616d.jpg)
Nepriamy efekt GLP1-RA na aterosklerózu ovplyvnením rizikových faktorov
Obezita a ateroskleróza
Vplyv obezity na riziko DM2T a ASKVO je všeobecne známy. Redukcia telesnej hmotnosti o aspoň 10 % je spájaná s ovplyvnením viacerých rizikových faktorov aterosklerózy (tlak krvi, lipidy, HbA1c) a poklesom KV-príhod [10,11]. GLP1-RA majú efekt na redukciu telesnej hmotnosti v rozmedzí 0,4–5,1 kg, respektíve až do hodnoty okolo 8 kg, pričom vo veľkých klinických štúdiách vykazoval najvyššiu redukciu telesnej hmotnosti semaglutid [12,13].
Lipidy a GLP1-RA
Dyslipidémia, špeciálne tzv. aterogénna dyslipidémia, ale aj postprandiálna hypertriglyceridémia sú častými sprievodnými ochoreniami u pacientov s DM2T. Metaanalýza štúdií s GLP1-RA preukázala redukciu LDL-cholesterolu (o 0,08– 0,16 mmol/l) ako aj celkového cholesterolu a triacylglycerolov [14]. Zdá sa, že tento efekt je sprostredkovaný inhibíciou produkcie apoB48 a poklesom postprandiálnych hladín chylomikrónov a remnantných častíc [15]. Liraglutid zvyšuje expresiu lipoproteinovej lipázy, znižuje apoB48 a expresiu génu pre MTP, ktoré ovplyvňujú tvorbu chylomikrónov, a zvyšuje tiež katabolizmus lipoproteínov nesúcich apoB100 a redukuje expresiu PCSK9 u pacientov s DM2T [16,17]. Pozitívny efekt na postprandiálne hladiny lipidov nie je limitovaný len na pacientov s DM, v 3-mesačnej klinickej štúdii viedlo podávanie semaglutidu v dávke 1 mg týždenne u obéznych nediabetikov k výraznej redukcii postprandiálnych hladín triglycerodov (TG), VLDL a apoB48 [18], pre podrobný prehľad o účinku GLP1-RA na postprandiálnu lipémiu odkazujem na recentný obsiahly prehľadový článok autorov Novodvorský a Haluzík [19]. Vzhľadom na vplyv GLP1-RA na príjem potravy a telesnú hmotnosť však nemožno vylúčiť ani tento mechanizmus ovplyvnenia lipidového profilu u pacientov s DM.
GLP1-RA a tlak krvi
GLP1 ovplyvňujú hodnoty tlaku krvi (TK) v závislosti od akútneho alebo chronického podávania. Pri akútnom podaní môže dôjsť k vzostupu TK, kým dlhodobé podávanie vedie k miernemu poklesu TK [15]. V prípade liraglutidu a exenatidu išlo o pokles systolického TK v rozmedzí 2,5–5,5 mm Hg a 2,9–4,7 mm Hg. Vo veľkých kardiovaskulárnych endpointových štúdiách vykazoval najlepší efekt na TK semaglutid v dávke 1,0 mg, ktorý signifikantne znižoval systolický tlak krvi o 5,4 mm Hg [13]. Efekt na TK sa prejavuje približne po 2 týždňoch liečby a následne potom počas liečby pretrváva [15]. Mechanizmus účinku na TK nie je jasný, in vitro liraglutid vyvolával vazodilatáciu a znižoval vaskulárnu kontrakciu [18], predpokladá sa vplyv na sympatikovú aktivitu, RAAS systém, GLP1-RA spôsobuje natriurézu a zvyšuje hladinu atriálneho nátriuretického peptidu [15]. Nemožno však znova vylúčiť ani efekt redukcie telesnej hmotnosti na TK pri liečbe GLP1-RA.
Vzhľadom na pokles KV-rizika už po len niekoľkých pár rokoch trvania štúdií naznačuje, že tento efekt bol dosiahnutý inými mechanizmami ako glykémiou znižujúcim efektom. Heuvelman et al vo svojom prehľadovom článku o KV-efekte GLP1-RA uvádzajú hypotetické výpočty poklesu KV-príhod podľa priemerného vplyvu GLP1-RA na niektoré rizikové faktory [15]. Redukcia systolického TK o 2 mm Hg pomocou GLP1-RA by takto mohla byť zodpovedná za cca 8 % a redukcia LDL-cholesterolu o 0,12 mmol/l za približne 3 % zníženie KV-príhod.
Priamy efekt GLP1-RA na aterosklerózu
Účinok GLP1-RA na funkciu endotelu bol preukázaný vo viacerých experimentálnych štúdiách [20]. Liraglutid aj dulaglutid ovplyvňujú zápal a dysfunkciu endotelu podmienenú oxLDL ovplyvnením Kruppel-like faktor 2 transkripčných faktorov [21,22]. Známy je tiež vplyv GLP1-RA na adhezívne vaskulárne molekuly, v experimente s endoteliálnymi bunkami u apoE-/- myší liraglutid inhiboval expresiu adhéznych molekúl VCAM1 a ICAM1 a selektínu E, pričom sa zdá, že tento efekt bol sprostredkovaný aktiváciou GLP1-RA [23]. Potrebujeme však viac dôkazov o expresii a účinkoch GLP1-RA1 v endoteliálnych bunkách a vaskulárnych bunkách hladkej svaloviny aj v in vivo štúdiách. Okrem adhéznych molekúl liraglutid v in vitro aj in vivo štúdiách tiež inhiboval PAI-1 a zvyšoval aktivitu NO syntázy [22]. Vo viacerých prácach bol tiež preukázaný vplyv GLP1-RA na inhibíciu NF-kB [9]. Preukázaný je tiež vplyv natívneho GLP1RA na zlepšenie tzv. flow-mediated vazodilatácie u oboch typov diabetu, v niektorých prípadoch nezávisle od zmien hladiny glukózy a inzulínu a efekt na flow-mediated vazodilatáciu bol zaznamenaný aj s GLP1-RA [25].
Dysfunkcia hladkej svaloviny cievnej steny zohráva dôležitú úlohu v procese aterosklerózy a jej moduláciou môže dôjsť k ovplyvneniu neželaného patogénneho remodelingu svalových buniek (VSMC – Vascular Smooth Muscle Cells). V in vitro štúdiách exenatid pozitívne ovplyvňoval moduláciu fenotypu VSMC a znižoval vplyv angiotenzínu II na VSMC [26,27].
Ateroskleróza sa dá pokladať za lipidmi riadené zápalové ochorenie [28] a potenciál GLP1-RA ovplyvňovať zápalový proces môže prispievať k znižovaniu výskytu KV-príhod. Potvrdenie a pochopenie protizápalového účinku GLP1-RA nám prinášajú aj nálezy z experimentálnych zvieracích modelov. V štúdii s apo E (apoE-/-) a LDL-receptor (LDLr-/-) deficientnými myšami (zvieracie modely aterosklerózy s léziami podobnými ako u ľudí) liraglutid a semaglutid významne tlmili rozvoj aterosklerotických plátov mechanizmami zahŕňajúcimi protizápalový efekt, pričom tento efekt bol len čiastočne ovplyvnený efektom na hmotnosť a cholesterol [29]. V časti s akútnym modelom zápalu semaglutid znižoval hladinu markerov systémového zápalu (TNFα, IFNγ a osteopontin), v transkriptomickej analýze aortálneho aterosklerotického tkaniva semaglutid down-reguloval expresiu viacerých zápalových génov relevantných pre atrakciu leukocytov (IL6, IL1 RN, CCL2), adhéziu/extravazáciu (VCAM1, SELE), metabolizmus proteínov extracelulárnej matrix (MMP3 a 13) a tiež pre metabolizmus cholesterolu (ABCA1, PTGIS) [29]. Podávanie GLP1-RA preukázalo aj vo viacerých (aj keď nie všetkých) humánnych štúdiách redukciu zápalových markerov u pacientov s DM2T alebo obezitou. Liraglutid, exenatid a semaglutid v klinických štúdiách znižovali hladiny zápalových cytokínov ako TNFα, IL1ß a IL6, a tiež redukovali hladinu CRP a hladiny adhezívnych molekúl ako VCAM-1 a ICAM-1 [15,30]. Štúdia s liraglutidom navyše ukázala redukciu zápalového procesu redukciou makrofágového aktivátora sCD163 [31].
Záver
U pacientov s DM2T GLP1-RA efektívne znižujú KV-riziko a zdá sa, že tento efekt môžeme pripísať iným ako glykémiu znižujúcim mechanizmom. Preukázaný benefit GLP1-RA možno vysvetliť vplyvom na niektoré konvenčné rizikové faktory, zdá sa však, že úlohu zohrávajú aj iné vlastnosti GLP1-RA, ako je ovplyvnenie funkcie endotelu, protizápalový a antiaterosklerotický efekt. Bez pochýb však možno konštatovať, že využitie GLP1-RA v liečbe pacientov s DM2T a redukcii ich KV-rizika má silnú oporu v preklinických aj klinických štúdiách, a právom preto patria do základnej výbavy liečby pacientov s DM.
Publikovanie práce bolo podporené spoločnosťou NovoNordisk Slovakia s.r.o.
Doručeno do redakce | Doručené do redakcie | Received 22. 5. 2022
Přijato po recenzi | Prijaté po recenzii | Accepted 27. 5. 2022
doc. MUDr. Branislav Vohnout, PhD.
www.uniba.sk
www.szu.sk
Zdroje
1. IDF Diabetes Atlas 2021. 10th edition. Dostupné z WWW: <http://www.diabetesatlas.org>.
2. Sarwar N, Gao P, Seshasai SR et al. Emerging Risk Factors Collaboration. Diabetes mellitus, fasting blood glucose concentration, and risk of vascular disease: a collaborative meta-analysis of 102 prospective studies. Lancet 2010; 375(9733): 2215–2222. Dostupné z DOI: <http://doi: 10.1016/S0140–6736(10)60484–9>.
3. Cosentino F, Grant PJ, Aboyans V et al. 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD. Eur Heart J 2020; 41(2): 255–323. Dostupné z DOI: <http://doi: 10.1093/eurheartj/ehz486>.
4. Ritsinger V, Hero C, Svensson AM et al. Characteristics and prognosis in women and men with type 1 diabetes undergoing coronary angiography: a nationwide registry report. Diabetes Care 2018; 41(4): 876–883. Dostupné z DOI: <http://doi: 10.2337/dc17–2352>.
5. Sex-specific relevance of diabetes to occlusive vascular and other mortality: a collaborative meta-analysis of individual data from 980 793 adults from 68 prospective studies. Endocrinol 2018; 6(7): 538–546. Dostupné z DOI: <http://doi:10.1016/S2213–8587(18)30079–2>.
6. Sharma D, Verma S, Vaidya S et al. Recent updates on GLP-1 agonists: Current advancements & challenges. Biomed Pharmacother 2018; 108: 952–962. Dostupné z DOI: <http://doi: 10.1016/j.biopha.2018.08.088>.
7. Drucker DJ, Nauck MA. The incretin system: glucagon-like peptide-1 receptor agonists and dipeptidyl peptidase-4 inhibitors in type 2 diabetes. Lancet 2006; 368(9548): 1696–1705. Dostupné z DOI: <http://doi: 10.1016/S0140–6736(06)69705–5>.
8. Giugliano D, Scappaticcio L, Longo M et al. GLP-1 receptor agonists and cardiorenal outcomes in type 2 diabetes: an updated meta-analysis of eight CVOTs. Cardiovasc Diabetol 2021; 20(1): 189. Dostupné z DOI: <http://doi: 10.1186/s12933–021–01366–8>.
9. Berndt J, Ooi SL, Pak SC. What Is the Mechanism Driving the Reduction of Cardiovascular Events from Glucagon-like Peptide-1 Receptor Agonists? – A Mini Review. Molecules 2021; 26: 4822. Dostupné z DOI: <https://doi.org/10.3390/molecules26164822>.
10. The Look AHEAD Research Group. Cardiovascular effects of intensive lifestyle intervention in type 2 diabetes. N Engl J Med 2013; 369(2): 145–154. Dostupné z DOI: <https://doi.org/10.1056/NEJMoa1212914>.
11. Gregg EW, Jakicic JM, Blackburn G et al. Look AHEAD Research Group. Association of the magnitude of weight loss and changes in physical fitness with longterm cardiovascular disease outcomes in overweight or obese people with type 2 diabetes: a post-hoc analysis of the Look AHEAD randomised clinical trial. Lancet Diabetes Endocrinol 2016; 4(11): 913–921. Dostupné z DOI: <https://doi.org/10.1016/S2213–587(16)30162–0>.
12. Sposito AC, Berwanger O, de Carvalho LSF et al. GLP-1RAs in type 2 diabetes: mechanisms that underlie cardiovascular effects and overview of cardiovascular outcome data. Cardiovasc Diabetol 2018; 17(1): 157. Dostupné z DOI: <https://doi: 10.1186/s12933–018–0800–2>.
13. Marso SP, Bain C, Consoli, A et al. Semaglutide and cardiovascular outcomes in patients with type 2 diabetes. N Engl J Med 2016; 375(19): 1834–1844. Dostupné z DOI: <https://doi: 10.1056/NEJMoa1607141>.
14. Sun F, Wu S, Wang J et al. Effect of glucagon-like peptide-1 receptor agonists on lipid profiles among type 2 diabetes: a systematic review and network meta-analysis. Clin Ther 2015; 37(1): 225–241. Dostupné z DOI: <https://doi:10.1016/j.clinthera.2014.11.008>.
15. Heuvelman V, Raalte D, Smits MM. Cardiovascular effects of glucagon-like peptide 1 receptor agonists: from mechanistic studies in humans to clinical outcomes. Cardiovasc Res 2020; 116(5): 916–930. Dostupné z DOI: <https://doi:10.1093/cvr/cvz323>.
16. Vergès B, Duvillard L, Pais de Barros JP et al. Liraglutide reduces postprandial hyperlipidemia by increasing ApoB48 (Apolipoprotein B48) catabolism and by reducing ApoB48 production in patients with type 2 diabetes mellitus. Arterioscler Thromb Vasc Biol 2018; 38(9): 2198–2206. Dostupné z DOI: <https://doi:10.1161/ATVBAHA.118.310990>.
17. Vergès B, Duvillard L, Pais de Barros JP et al. Liraglutide increases the catabolism of apolipoprotein B100-containing lipoproteins in patients with type 2 diabetes and reduces proprotein convertase subtilisin/kexin type 9 expression. Diabetes Care 2021; 44(4): 1027–1037. Dostupné z DOI: <https://doi: 10.2337/dc20–1843>.
18. Hjerpsted JB, Flint A, Brooks A et al. Semaglutide improves postprandial glucose and lipid metabolism, and delays first-hour gastric emptying in subjects with obesity. Diabetes Obes Metab 2018; 20(3): 610–619. Dostupné z DOI: <https://doi.org/10.1111/dom.13120>.
19. Novodvorský P, Haluzík M. The Effect of GLP‑1 Receptor Agonists on Postprandial Lipaemia. Curr Atheroscler Rep 2022; 24: 13–21. Dostupné z DOI: <https://doi.org/10.1007/s11883–022–00982–3>.
20. Liu L, Liu J, Huang Y. Protective Effects of Glucagon-like Peptide 1 on Endothelial Function in Hypertension. J. Cardiovasc. Pharmacol 2015; 65: 399–405. Dostupné z DOI: <https://doi.org/ 10.1097/FJC.0000000000000176>.
21. Chang W, Zhu F, Zheng H et al. Glucagon-like peptide-1 receptor agonist dulaglutide prevents ox-LDL-induced adhesion of monocytes to human endothelial cells: An implication in the treatment of atherosclerosis. Mol Immunol 2019; 116: 73–79. Dostupné z DOI: <https://doi.org/10.1016/j.molimm.2019.09.021>.
22. Yue W, Li Y, Ou D et al. The GLP-1 receptor agonist liraglutide protects against oxidized LDL-induced endothelial inflammation and dysfunction via KLF2. IUBMB Life 2019; 71(9): 1347–1354. Dostupné z DOI: <https://doi.org/10.1002/iub.2046>.
23. Gaspari T, Liu H, Welungoda I et al. A GLP-1 receptor agonist liraglutide inhibits endothelial cell dysfunction and vascular adhesion molecule expression in an ApoE -/- mouse model. Diabetes Vasc Dis Res 2011; 8(2): 117–124. Dostupné z DOI: <https://doi.org/10.1177/1479164111404257>.
24. Del Olmo-Garcia MI, Merino-Torres JF. GLP-1 Receptor Agonists and Cardiovascular Disease in Patients with Type 2 Diabetes. J Diabetes Res 2018; 2018: 4020492. Dostupné z DOI: <https://doi: 10.1155/2018/4020492>.
25. Drucker DJ. The Ascending GLP-1 Road From Clinical Safety to Reduction of Cardiovascular Complications. Diabetes 2018; 67(9): 1710–1719. Dostupné z DOI: <https://doi: 10.2337/dbi18–0008>.
26. Liu Z, Zhang M, Zhou T et al. Exendin-4 promotes the vascular smooth muscle cell re-differentiation through AMPK/SIRT1/FOXO3a signaling pathways. Atherosclerosis 2018; 276: 58–66. Dostupné z DOI: <https://doi: 10.1016/j.atherosclerosis.2018.07.016>.
27. Jojima T, Uchida K, Akimoto K et al. Liraglutide, a GLP-1 receptor agonist, inhibits vascular smooth muscle cell proliferation by enhancing AMP-activated protein kinase and cell cycle regulation, and delays atherosclerosis in ApoE deficient mice. Atherosclerosis 2017; 261: 44–51. Dostupné z DOI: <https://doi:10.1016/j.atherosclerosis.2017.04.001>.
28. Vohnout B, de Gaetano G, Donati MB et al. The Relationship between Dyslipidemia and Inflammation. In: M. Mancini, J. Ordovas, G. Riccardi et al (eds). Nutritional and Metabolic Bases of Cardiovascular Disease. Blackwell Publishing 2011: 202–210. ASIN: B005D7EPG0.
29. Rakipovski G, Rolin B, Nohr J et al. The GLP-1 Analogs Liraglutide and Semaglutide Reduce Atherosclerosis in ApoE-/- and LDLr-/- Mice by a Mechanism That Includes Inflammatory PathwaysJ Am Coll Cardiol Basic Trans Science 2018; 3(6): 844–857. Dostupné z DOI: <https://doi: 10.1016/j.jacbts.2018.09.004>.
30. Saraiva JF, Franco D. Oral GLP-1 analogue: perspectives and impact on atherosclerosis in type 2 diabetic patiensts. Cardiovasc Diab 2021; 20: 235. Dostupné z DOI: <https://doi: 10.1186/s12933–021–01417–0>.
31. Nauck MA, Meier JJ, Cavender MA et al. Cardiovascular actions and clinical outcomes with glucagon-like peptide-1 receptor agonists and dipeptidyl eptidase- 4 inhibitors. Circulation 2017; 136(9): 849–870. Dostupné z DOI: <https://doi: 10.1161/CIRCULATIONAHA.117.028136>.
Štítky
Angiologie Diabetologie Interní lékařství Kardiologie Praktické lékařství pro dospěléČlánek vyšel v časopise
Athero Review

2022 Číslo 2
Nejčtenější v tomto čísle
- Přínosy léčby agonisty GLP1-receptorů pro pacienty s kardiovaskulárním onemocněním
- Deficit lyzosomální kyselé lipázy – diferenciální diagnostika a možnosti léčby v roce 2022
- Ako sme na tom s dosahovaním cieľových hladín LDL-cholesterolu na Slovensku u vysokorizikovej populácie: retrospektívna štúdia
- Rizikové faktory, jejich celoživotní expozice a trajektorie – nový směr v odhadu rizika ASKVO
