RNA-interference – nový perspektivní směr ve vývoji léků
RNA interference – new prospective direction in drug development
Biological therapy, whose mechanism of action is the use of monoclonal antibodies against a protein, has been used in clinical practice for many years. However, new drugs from the group of biological therapies that act on the principle of RNA interference are now entering clinical practice. RNA interference is the process by which cells in all living organisms regulate the expression of their genes, and in which the transfer of information about the synthesis of a particular protein between DNA and ribosomes can be stopped. For therapeutic purposes, this effect is achieved by administering artificially synthesized oligonucleotides – short chains of RNA with a precise nucleoside sequence. These are either short stretches of double- stranded RNA or single-stranded oligonucleotides. For clinical use, their chemical modification was necessary to increase their stability and remove some of their side effects, and then binding to other substances to allow their targeted transport to the desired tissue. A number of these drugs are already in advanced stages of clinical trials, and some are entering the pharmaceutical market.
Keywords:
biological therapy – Small interfering RNA – LDL-cholesterol – antisense oligonucleotide – N-acetylgalactosamine – RNA-interference
Autoři:
Vladimír Soška 1,2; Ondřej Kyselák 1,3
Působiště autorů:
Oddělení klinické biochemie FN U sv. Anny v Brně
1; II. interní klinika LF MU a FN U sv. Anny v Brně
2; Katedra laboratorních metod LF MU, Brno
3
Vyšlo v časopise:
AtheroRev 2023; 8(1): 38-44
Kategorie:
Přehledové práce
Souhrn
Biologická terapie, jejímž mechanizmem účinku je použití monoklonálních protilátek proti nějakému proteinu, je používána v klinické praxi již řadu let. V současné době ale vstupují do klinické praxe nové léky ze skupiny biologické terapie, které účinkují na principu RNA-interference. RNA-interference je proces, kterým buňky všech živých organizmů regulují expresi svých genů a při kterém může být zastaven přenos informace o syntéze konkrétního proteinu mezi DNA a ribosomy. Pro terapeutické účely se tohoto efektu dosahuje podáním umělých syntetizovaných oligonukleotidů s přesně danou sekvencí nukleosidů. Jde buď o krátké úseky dvouvláknové RNA, nebo o jednovláknové oligonukleotidy. Pro klinické využití byla nutná pro zvýšení jejich stability a odstranění některých nežádoucích účinků jejich chemická modifikace, a dále pak vazba na další substance, které umožní jejich cílený transport do požadované tkáně. Celá řada těchto léků je již v pokročilých fázích klinických studií a některé z nich vstupují na farmaceutický trh.
Klíčová slova:
LDL-cholesterol – biologická terapie – antisense oligonukleotid – N-acetylgalaktosamin – RNA-interference – malá interferující RNA
Úvod
V terapii řady onemocnění, včetně dyslipidemií a aterosklerózy, se již řadu let používají léky, řazené do skupiny tzv. biologické terapie. Nejrozšířenější formou této biologické terapie je v současnosti použití monoklonálních protilátek, které jsou cíleny na jeden konkrétní protein, který se na rozvoji či průběhu nemocí podílí. Příkladem z oblasti dyslipidemie jsou PCSK9-inhibitory (PCSK9i), využívané v terapii hypercholesterolemie. Jde o monoklonální protilátky proti proteinu PCSK9 (proprotein konvertáza subtilizin/kexin typu 9). Tento protein snižuje počet LDL-receptorů, protože urychluje jejich degradaci. Snížení počtu LDL-receptorů má za následek pomalejší vychytávání lipoproteinů LDL z krve, takže hladina LDL-cholesterolu (LDL-C) se zvyšuje. Podáním monoklonální protilátky dojde k inaktivaci proteinu PCSK9, tím se zvyšuje počet LDL-receptorů na povrchu buněk, zrychluje se odstraňování LDL-partikulí z cirkulace a hladina LDL-C se snižuje. V současné době ale vstupuje na trh nová skupina léků, které lze také řadit do skupiny biologické terapie, ale které jsou založené na principu tzv. RNA-interference. Tyto léky inhibují syntézu konkrétního proteinu, v případě hypercholesterolemie jsou cíleny většinou právě na protein PCSK9.
Schéma přenosu informace od DNA k syntéze proteinu
Zjednodušené schéma procesu od přepisu informace z DNA k syntéze proteinu ukazuje schéma 1. Informace pro syntézu konkrétního proteinu je přepsána z DNA do messenger RNA (mRNA), tento proces se nazývá transkripce. Po sestřihu je mRNA dopravena z jádra buňky do cytoplazmy k ribosomům, kde je podle této informace protein syntetizován. Tento proces se nazývá translace. Je to relativně komplikovaný děj, ke kterému je nutná (mimo jiné) účast dalších 2 typů RNA: transferová RNA (tRNA), která „přečte“ informaci nesenou mRNA, a ribosomální RNA (rRNA), která se podílí ve spolupráci s katalytickými proteiny na správném řazení jednotlivých aminkoyselin a jejich vzájemnou vazbu při syntéze cílové bílkoviny.

V případě léků ze skupiny monoklonálních protilátek mluvíme o tzv. posttranslačním umlčení proteinu – funkční protein byl syntetizován, ale byl inaktivován vazbou specifické (monoklonální) protilátky. Léky na principu RNA-interference (RNAi) účinkují o jeden stupeň dříve na úrovni mRNA, která je degradována mechanizmem popsaným v tomto článku níže, takže k syntéze cílového proteinu vůbec nedojde. Tento proces se nazývá „posttranskripční umlčení genu“ (schéma 1).
Princip RNA-interference
Princip RNAi objasnili v 90. letech minulého století vědci Andrew Z. Fire a Craig C. Mello, kteří za tento objev obdrželi v roce 2006 Nobelovu cenu za fyziologii a medicínu. Své experimenty prováděli na háďátku obecném (Caenorhabditis elegans), u kterého úspěšně inhibovali expresi specifických genů (tedy syntézu konkrétních proteinů) zavedením krátkých segmentů dvouvláknové RNA (dsRNA – double-stranded RNA) do jeho buněk [1]. RNAi je fyziologický mechanizmus, který pravděpodobně vznikl primárně jako obrana buněk proti virovým infekcím. Princip RNAi spočívá v tom, že se krátký řetězec jednovláknové RNA, který má sekvenci nukleosidů plně komplementární k cílové mRNA, naváže na tuto mRNA. Výsledkem této vazby jsou procesy, které vedou k degradaci (rozštěpení) cílové mRNA, takže ta již nemůže předat informaci k syntéze proteinu na ribosomy. RNA interference je proto také definována jako útlum genové exprese pomocí krátkých fragmentů RNA. Mechanizmus fyziologické RNAi v buňkách probíhá ve třech krocích (schéma 2).
![Schéma 2. Mechanizmus fyziologické RNA-interference. Upraveno podle [2]](https://pl-master.mdcdn.cz/media/image_pdf/037653b758d991116e2b03f6a7be1b53.png?version=1676825894)
KROK 1: dsRNA je rozštěpena specifickou endonukleázou zvanou DICER. Vznikají tak krátké dvouřetězcové oligonukleotidy obsahující 20–25 párů bazí označovaných siRNA (short-interfering RNA).
KROK 2: siRNA se naváže na specifický proteinový komplex RISC (RNA-Induced Silencing Complex), jehož součástí je enzym nukleáza, která oba řetězce siRNA oddělí od sebe. Na jeden z řetězců, který obsahuje komplementární sekvenci k cílové mRNA, je tato mRNA navázána (druhý řetězec původní siRNA, který obsahuje totožnou sekvenci jako cílová mRNA, je degradován).
KROK 3: Takto vzniklý komplex vykazuje endonukleázovou aktivitu, je schopen navázanou mRNA rozštěpit a znemožnit tak její použití jako templátu pro translaci. Fragmenty degradované mRNA se odpojí od komplexu RISC a celý proces se může opakovat. Tímto způsobem může jedna molekula siRNA vyhledat a inaktivovat mnoho molekul cílové mRNA [2].
Při využití tohoto mechanizmu pro terapeutické účely jsou podávány synteticky připravené krátké řetězce dvouvláknové siRNA, takže výše popsaný proces RNAi probíhá až od bodu 2 (není nutný první krok, ve kterém je štěpen celý řetězce dsRNA endonukleázou DICER na krátké fragmenty). Schéma pro terapeutické využití siRNA znázorňuje schéma 3.
![Schéma 3. Terapeutické využití RNA-interference.
Upraveno podle [3]](https://pl-master.mdcdn.cz/media/image_pdf/91d4d2a428989bd980e72a62372c18ac.png?version=1676825997)
siRNA vstupuje do cytoplazmy buňky a váže se na RISC- -komplex, jehož součástí je Argonaute 2 nukleáza (Ago2), která od sebe oddělí obě vlákna siRNA. Vlákno siRNA, které má totožnou sekvenci nukleosidů jako cílová mRNA (sense vlákno, passenger vlákno), je odstraněno. Druhé vlákno, které má komplementární sekvenci nukleosidů k cílové mRNA (antisense vlákno, guide vlákno) je komplexem RISC navedeno k příslušné cílové mRNA, která je poté degradována. Degradované fragmenty mRNA jsou odpojeny a RISC-komplex s vodícím vláknem se může vázat na další molekulu cílové mRNA [3].
Antisense oligonukleotidy
Jinou možností, která využívá proces RNAi k degradaci cílové mRNA, je použití antisense oligonukleotidů (ASO) [4]. ASO je syntetický jednovláknový oligonukleotid (RNA, nebo DNA), obvykle o délce 15–30 nukleosidů, který má (podobně jako antisense vlákno siRNA) sekvenci nukleosidů plně komplementární k cílové mRNA [5]. Bývá označován také jako ssASO (jednovláknový – single strand ASO). Porovnání schematického znázornění struktury siRNA a ssASO (obr. 1).

Zatímco siRNA působí RNAi pouze v cytoplazmě buňky, ASO může vstupovat nejen do cytoplazmy buňky, ale i do buněčného jádra, v němž jsou také přítomny molekuly mRNA. ASO se tedy v tomto případě váže na komplementární řetězec mRNA v cytoplazmě i v jádře a degraduje cílovou mRNA. Mechanizmus degradace mRNA pomocí ASO je ale odlišný od mechanizmu, kterým působí siRNA. siRNA musí být nejprve navázána do komplexu RISC, kde jsou od sebe odděleny oba řetězce siRNA a řetězec s komplementární sekvencí nukleosidů je použit pro degradaci mRNA. ssASO má jen jeden (komplementární) řetězec, který se váže přímo na cílovou mRNA, aniž by byl vázán do komplexu RISC. Vazbou ASO na mRNA je aktivována H1-RNáza, což je ubikvitární buněčný enzym, štěpící řetězce mRNA. Výsledkem je fragmentace a degradace cílové mRNA. Vlákno ASO je poté uvolněno a může se vázat na další molekulu cílové mRNA [6]. Schematicky proces znázorňuje schéma 4.
![Schéma 4. Mechanizmus účinku antisense
oligonukleotidu. Upraveno podle [6]](https://pl-master.mdcdn.cz/media/image_pdf/b66e1005ec8bf5d2ef69247de3021e5a.png?version=1676826415)
I když je výsledný efekt stejný v případě siRNA i ASO, přesto se od sebe tyto oligonukleotidy některými vlastnostmi liší. Některé rozdíly mezi siRNA a ASO jsou uvedeny v tab. 1. Pro využití v terapii ale nelze použít nativní siRNA ani ASO pro jejich nevhodné vlastnosti v oblasti biodistribuce, farmakokinetiky i imunogenicity [5].
![Některé rozdíly mezi siRNA a antisense oligonukleotidy. Upraveno podle [3]](https://www.atheroreview.eu/media/cache/resolve/media_object_image_small/media/image_pdf/e19ff2fc78e522049f88b216fb060d93.png)
Problémy ve využití nativních syntetických oligonukleotidů (siRNA, ASO) v terapii
Nativní syntetické siRNA i ssASO je nutné podávat parenterálně, protože jsou v zažívacím traktu degradovány. Po jejich parenterálním podávání se ale projeví v plné míře jejich nepříznivé vlastnosti, které ztěžují (nebo znemožňují) jejich využití v terapii. Bylo nutné vyřešit 3 hlavní okruhy problémů:
- malá stabilita (krátký biologický poločas)
- nedostatečná rezistence vůči endonukleázám
- zvýšená imunoreaktivita
siRNA i ASO jsou v organizmu velmi rychle degradovány celou řadou mechanizmů. V krevním řečišti interagují s proteiny, jsou vychytávány retikuloendoteliálním systémem, jsou eliminovány ledvinami a rychle štěpeny enzymy – nukleázami. Po vstupu do buněk jsou štěpeny nukleázami a degradovány v endosomech, takže jen jejich nepatrná část by mohla splnit úkol degradace cílové mRNA pro syntézu vybraného proteinu. K tomu, aby se projevil dostatečný klinický efekt, by musely být podávány velmi často a ve vysokých dávkách. Dalším problémem je jejich zvýšená imunoreaktivita: aktivují komplement a způsobují výrazné nežádoucí účinky nejen lokální v místě vpichu, ale i celkové [3].
Cílem dalšího vývoje proto bylo vyvinout takové modifikace siRNA a ASO, u kterých by byly tyto nežádoucí vlastnosti potlačeny, resp. eliminovány.
Chemická modifikace syntetických oligonukleotidů
Vyvíjeny a zkoušeny byly různé způsoby chemické modifikace oligonukleotidů s cílem zvýšit jejich rezistenci vůči degradaci nukleázami, potlačit jejich imunoreaktivitu a zvýšit jejich afinitu k cílové mRNA. Podařilo se postupně vyvinout 3 generace oligonukleotidů [7]. Jejich úpravy spočívají v různých způsobech chemické modifikace všech 3 základních složek oligonukleotidů: fosfodiesterových vazeb, ribózového skeletu i vlastních nukleových bází. Podrobnosti týkající se chemické modifikace nejsou předmětem tohoto článku a případné zájemce odkazuji na některé publikace, které se touto problematikou zabývají [6,8].
Výsledkem dlouhé řady experimentů jsou v současné době používané oligonukleotidy, které jsou stabilní, jsou rezistentní vůči endonukleázám, mají výrazně potlačenu imunoreaktivitu a toxicitu a mají zvýšenou afinitu k hybridizaci s cílovou mRNA [9,10].
Příkladem oligonukleotidů s ještě ne zcela optimální chemickou modifikací 2. generace je mipomersen, který byl schválen v USA k terapii homozygotní formy familiární hypercholesterolemie. Jednalo se o ASO cílený proti mRNA pro syntézu apolipoproteinu B. Byl sice již rezistentní proti endonukleázám, ale měl poměrně výraznou zbytkovou imunoreaktivitu. Aplikoval se 1krát týdně s.c. a způsoboval výrazné kožní reakce v místě vpichu a také symptomy podobné chřipce. Měl navíc také potenciál hepatotoxicity (jaterní steatóza), což bylo vedlejším efektem útlumu syntézy apolipoproteinu B (retence nejen cholesterolu, ale i triacylglycerolů v hepatocytech). Pro tyto nežádoucí účinky byl nakonec stažen z klinického použití [11].
Doručení oligonukleotidů do cílových orgánů
Dalším problémem, který komplikoval využití siRNA a ASO pro terapeutické účely, byla nevyřešená otázka, jak doručit siRNA/ASO do cílové tkáně (např. CNS, játra), kde mělo být těžiště jejich účinku [7]. Při parenterálním podání jsou antisense oligonukleotidy distribuovány do celého organizmu, takže mohou působit i tam, kde to není žádoucí, a naopak se nemusejí v dostatečné koncentraci dostat tam, kde požadujeme jejich účinek. Byla zkoušena řada způsobů jak doručit oligonukleotidy do cílové tkáně přes biologické bariéry, např. pomocí konjugace s mastnými kyselinami, polyetylenglykolem, některými peptidy, či vazba na protilátky [12]. Dalšími způsoby je vazba na polymerní částice, např. lipid-polymer nanočástice, dendrimery, peptidové komplexy, cyklodextriny, exozomy, či lipid-polymerní hybridní částice [7,13–15].
Doručení oligonukleotidů do jater
U velké části onemocnění, u kterých mohou být siRNA a ASO využity k terapii, jsou cílovým orgánem játra. Tam je syntetizována celá řada specifických bílkovin, jejichž down-regulace může být cílem terapie a systémové působení RNAi není žádoucí. Cílem dalšího výzkumu proto bylo hledání způsobu, jak „doručit“ siRNA i ASO cíleně do jaterních buněk. Zásadním průlomem na této cestě byl objev molekuly GalNAc (N-acetylgalaktosamin) (obr. 2) [16].
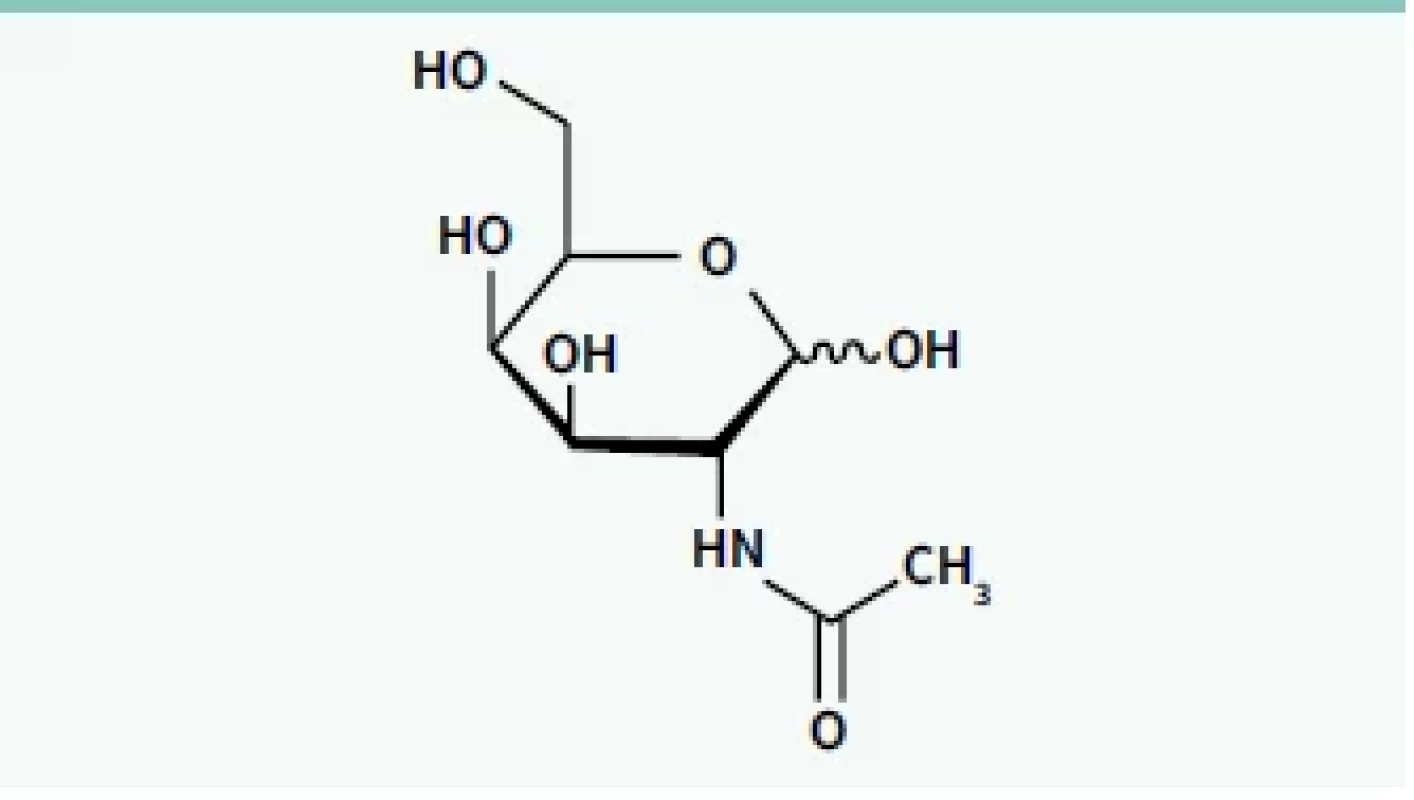
GalNAc se váže specificky na asialoglykoproteinový receptor (ASGPR) na povrchu hepatocytů. Tento receptor je exprimován na sinusoidálním povrchu hepatocytů a nevyskytuje se v žádné jiné tkáni. Další výhodou je skutečnost, že má vysokou kapacitu a schopnost rychlé internalizace vazebné substance (GalNAc). Protože ASGPR má 3 vazebná místa pro GalNAc, bylo nutné syntetizovat tzv. „triantenární“ molekulu GalNAc, tedy strukturu, ve které jsou správně prostorově orientovány 3 molekuly GalNAc. Na ni pak může být konjugován příslušný oligonukleotid (ASO, siRNA), který potřebujeme doručit do jater (schéma 5) [17].
![Schéma 5. Struktura triantenálního konjugátu
GalNAc (s navázanými oligonukleotidy)
a ASGP-receptoru. Upraveno podle [17]](https://pl-master.mdcdn.cz/media/image_pdf/5caedbb0fa0eaa99a5a6194d690c29e4.png?version=1676826448)
Mechanizmus procesu vstupu celého konjugátu do hepatocytu je následující: ASGPR naváže 3 molekuly GalNAc i s konjugovaným oligonukleotidem a celý komplex je internalizován. V endozomech je konjugát rozštěpen na 3 části: ASGPR, který recykluje zpět na povrch hepatocytu, GalNAc, který je degradován, a vlastní oligonukleotid, který je uvolněn do cytoplazmy hepatocytu, kde může spustit svoji aktivitu – RNAi (schéma 6) [18].
![Schéma 6. Transport konjugátu GalNAc s oligonukleotidy do hepatocytu. Upraveno podle [18]](https://pl-master.mdcdn.cz/media/image_pdf/6d1ab90f65e02fec4e9c3c610f3bd004.png?version=1676826474)
Objev GalNAc a schopnosti jeho vazby na ASGPR v hepatocytech, syntéza triantenálního GalNAc a jeho konjugace se siRNA a ASO způsobily malou „revoluci“ ve výzkumu a využití RNAi pro terapeutické účely a tohoto mechanismu nyní využívá celá řada syntetických oligonukleotidů, které jsou testovány v klinických studiích.
Přehled některých oligonukleotidů v pokročilých fázích vývoje
V současné době je již v pokročilé fázi klinických studií zkoušena celá řada preparátů na principu RNAi, ať již ASO, nebo siRNA, přičemž řada z nich je konjugována s GalNAc (tab. 2). Ve vývoji je i řada oligonukleotidů určených pro terapii dyslipidemií a aterosklerózy (tab. 3) [19–21]. První z této skupiny léků snižující LDL-C, který již je schválen v Evropě ke klinickému použití, je inklisiran. Jde o konjugát GalNAc se siRNA, která je cílená proti mRNA pro syntézu proteinu PCSK9 v játrech. Tento preparát snižuje LDL-C asi o 50 % a protože má dlouhý biologický poločas (odolnost vůči degradaci), stačí jej aplikovat podkožně 1krát za 6 měsíců.
![Příklady vyvíjených preparátů ze skupiny oligonukleotidů. Upraveno podle [18]](https://www.atheroreview.eu/media/cache/resolve/media_object_image_small/media/image_pdf/8932792b31ddb372c3fcb5a6eaddb2fb.png)
![Příklady preparátů ze skupiny oligonukleotidů cílené na terapii dyslipidemií (řazeno abecedně).
Upraveno podle [18,20]](https://www.atheroreview.eu/media/cache/resolve/media_object_image_small/media/image_pdf/67340bba6685f1450e4fb4ea7dcd7f76.png)
Současná terapie založené na RNA-interferenci má oproti konvenční terapii řadu výhod: je přesně cílená na jediný konkrétní protein, jehož funkci potřebujeme ovlivnit, je vysoce účinná a má minimum nežádoucích účinků. Navíc syntéza oligonukleotidů je relativně jednoduchá a rychlá. Je otázka, zda se do budoucna prosadí více ASO nebo siRNA. ASO mají většinou větší efekt na útlum syntézy proteinu, naproti tomu siRNA má delší biologický poločas (životnost v buňkách) a aplikace stačí v delších časových intervalech. Orientačně lze konstatovat, že ASO bývá nutné aplikovat řádově 1krát za měsíc, zatímco v případě siRNA může stačit aplikace 1krát za 6 měsíců [20]. Je ale možné, že další vývoj chemických modifikací tyto rozdíly ještě změní.
Závěr
Nově nastupující biologická terapie založená na RNA-interferenci bude do budoucna nepochybně zásadní pro další rozvoj terapie nejen dyslipidemií a kardiovaskulárních onemocnění, ale celé řady dalších chorob, na které doposud nebyly k dispozici účinné léky. Nové preparáty účinkující mechanizmem RNAi (ať již si RNA, nebo ASO) prokázaly či prokazují v klinických studiích velmi slibné výsledky. Technologie otevírají dveře k vysoce cílené a účinné terapii cestou útlumu exprese cílových genů. Zavedení konjugace těchto preparátů s GalNAc umožňuje jejich cílený a vysoce selektivní transport do jater, a tím i snížení kumulativních dávek léků, které musejí být podávány. Tyto léky mohou způsobit revoluci v paradigmatu terapie velmi širokého spektra onemocnění. Ve vývoji jsou již i preparáty, jejichž účinek je založen na RNAi s využitím mikroRNA, která patří mezi hlavní fyziologické regulační mechanizmy exprese genů u člověka [22].
Doručeno do redakce | Doručené do redakcie | Received 7. 1. 2023
Přijato po recenzi | Prijaté po recenzii | Accepted 27. 1. 2023
prof. MUDr. Vladimír Soška, CSc.
Zdroje
1. Fire A, Xu S, Montgomery MK et al. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature 1998; 391(6669): 806–811. Dostupné z DOI: <http://dx.doi.org/10.1038/35888>.
2. Kodíček M. RNA-interference. Biochemické pojmy: výkladový slovník [online] 2007. VŠCHT: Praha 2007. Dostupné z WWW: <http://vydavatelstvi. vscht.cz/knihy/uid_es-002/ebook.html?p=rna-interference>.
3. Mendonca MC, Kont A, Aburto MR et al. Advances in the Design of (Nano)Formulations for Delivery of Antisense Oligonucleotides and Small Interfering RNA: Focus on the Central Nervous System. Mol Pharm 2021; 18(4): 1491–1506. Dostupné z DOI: <http://dx.doi.org/10.1021/acs.molpharmaceut. 0c01238>.
4. Di Fusco D, Dinallo V, Marafini I et al. Antisense Oligonucleotide: Basic Concepts and Therapeutic Application in Inflammatory Bowel Disease. Front Pharmacol 2019; 10: 305. Dostupné z DOI: <http://dx.doi. org/10.3389/fphar.2019.00305>.
5. Havens MA, Hastings ML. Splice-switching antisense oligonucleotides as therapeutic drugs. Nucleic Acids Res 2016; 44(14): 6549–6563. Dostupné z DOI: <http://dx.doi.org/10.1093/nar/gkw533>.
6. Crooke ST, Liang XH, Baker BF et al. Antisense technology: A review. J Biol Chem 2021; 296: 100416. Dostupné z DOI: <http://dx.doi.org/ 10.1016/j.jbc.2021.100416>.
7. Hammond SM, Aartsma-Rus A, Alves S et al. Delivery of oligonucleotide- based therapeutics: challenges and opportunities. EMBO Mol Med 2021; 13(4): e13243. Dostupné z DOI: <http://dx.doi.org/10.15252/ emmm.202013243>.
8. Anderson BA, Freestone GC, Low A et al. Towards next generation antisense oligonucleotides: mesylphosphoramidate modification improves therapeutic index and duration of effect of gapmer antisense oligonucleotides. Nucleic Acids Res 2021; 49(16): 9026–9041. Dostupné z DOI: <http:// dx.doi.org/10.1093/nar/gkab718>.
9. Deleavey GF, Damha MJ. Designing chemically modified oligonucleotides for targeted gene silencing. Chem Biol 2012; 19(8): 937–954. Dostupné z DOI: <http://dx.doi.org/10.1016/j.chembiol.2012.07.011>.
10. Chi X, Gatti P, Papoian T. Safety of antisense oligonucleotide and siRNA- based therapeutics. Drug Discov Today 2017; 22(5): 823–833. Dostupné z DOI: <http://dx.doi.org/10.1016/j.drudis.2017.01.013>.
11. Tsimikas S, Moriarty PM, Stroes ES. Emerging RNA Therapeutics to Lower Blood Levels of Lp(a): JACC Focus Seminar 2/4. J Am Coll Cardiol 2021; 77(12): 1576–1589. Dostupné z DOI: <http://dx.doi.org/10.1016/j. jacc.2021.01.051>.
12. Roberts TC, Langer R, Wood MJA. Advances in oligonucleotide drug delivery. Nat Rev Drug Discov 2020; 19(10): 673–694. Dostupné z DOI: <http://dx.doi.org/10.1038/s41573–020–0075–7>.
13. Singh BN, Prateeksha, Gupta VK et al. Organic Nanoparticle-Based Combinatory Approaches for Gene Therapy. Trends Biotechnol 2017; 35(12): 1121–1124. Dostupné z DOI: <http://dx.doi.org/10.1016/j.tibtech. 2017.07.010>.
14. Das CK, Jena BC, Banerjee I et al. Exosome as a Novel Shuttle for Delivery of Therapeutics across Biological Barriers. Mol Pharm 2019; 16(1): 24–40. Dostupné z DOI: <http://dx.doi.org/10.1021/acs.molpharmaceut. 8b00901>.
15. Yang L, Ma F, Liu F et al. Efficient Delivery of Antisense Oligonucleotides Using Bioreducible Lipid Nanoparticles In Vitro and In Vivo. Mol Ther Nucleic Acids 2020; 19: 1357–1367. Dostupné z DOI: <http://dx.doi.org/ 10.1016/j.omtn.2020.01.018>.
16. Prakash TP, Graham MJ, Yu J et al. Targeted delivery of antisense oligonucleotides to hepatocytes using triantennary N-acetyl galactosamine improves potency 10-fold in mice. Nucleic Acids Res 2014; 42(13): 8796– 8807. Dostupné z DOI: <http://dx.doi.org/10.1093/nar/gku531>.
17. Shen X, Corey DR. Chemistry, mechanism and clinical status of antisense oligonucleotides and duplex RNAs. Nucleic Acids Res 2018; 46(4): 1584–1600. Dostupné z DOI: <http://dx.doi.org/10.1093/nar/gkx1239>.
18. Cui H, Zhu X, Li S et al. Liver-Targeted Delivery of Oligonucleotides with N-Acetylgalactosamine Conjugation. ACS Omega 2021; 6(25): 16259– 16265. Dostupné z DOI: <http://dx.doi.org/10.1021/acsomega.1c01755>.
19. Parolini C. Biotechnology Approaches for the Treatment of Dyslipidemia. Cardiovasc Drugs Ther 2021; 35(1): 167–183. Dostupné z DOI: <http:// dx.doi.org/10.1007/s10557–020–07017–6>.
20. Gareri C, Polimeni A, Giordano S et al. Antisense Oligonucleotides and Small Interfering RNA for the Treatment of Dyslipidemias. J Clin Med 2022; 11(13): 3884. Dostupné z DOI: <http://dx.doi.org/10.3390/jcm11133884>.
21. Yamamoto T, Wada F, Harada-Shiba M. Development of Antisense Drugs for Dyslipidemia. J Atheroscler Thromb 2016; 23(9): 1011–1025. Dostupné z DOI: <http://dx.doi.org/10.5551/jat.RV16001>.
22. Bajan S, Hutvagner G. RNA-Based Therapeutics: From Antisense Oligonucleotides to miRNAs. Cells 2020; 9(1): 137. Dostupné z DOI: <http:// dx.doi.org/10.3390/cells9010137>.
Štítky
Angiologie Diabetologie Interní lékařství Kardiologie Praktické lékařství pro dospěléČlánek vyšel v časopise
Athero Review

2023 Číslo 1
Nejčtenější v tomto čísle
- Jak na to, aby léčba byla rychlejší než ateroskleróza
- Kardiovaskulární riziko: od významu přes stanovení po komunikaci s pacientem
- Lipitenzia: nové možnosti kombinovanej liečby
- 95. percentil LDL-cholesterolu v české populaci: studie Czech post-MONICA
