Co přinesly zobrazovací studie s evolokumabem?
What have imaging studies with evolocumab yielded?
This review describes usual endpoints in trials assessing changes of atherosclerotic plaques during lipid-lowering therapy. Authors focus their attention to the trials using evolocumab as an active drug.
Keywords:
optical coherence tomography – evolocumab – atherosclerosis regression – intravascular ultrasound
Autoři:
Tomáš Kovárník 1; Karel Kopřiva 2; Jan Pudil 1; Zhi Chen 3; Milan Šonka 3
Působiště autorů:
II. interní klinika kardiologie a angiologie 1. LF UK a VFN v Praze
1; Kardiologie (KAR), Nemocnice Na Homolce, Praha
2; Dept. of Electrical & Computer Engineering and Iowa Institute for Biomedical Imaging, The University of Iowa, Iowa City, IA, USA
3
Vyšlo v časopise:
AtheroRev 2022; 7(3): 159-165
Kategorie:
Klinické studie
Souhrn
Autoři uvádějí přehled sledovaných parametrů ve studiích hodnotících změny aterosklerotických plátů při hypolipidemické terapii. Dále jsou komentovány studie, které jako aktivní léčbu používaly evolokumab.
Klíčová slova:
optická koherentní tomografie – evolokumab – intravaskulární ultrasonografie – regrese aterosklerózy
Úvod
Velké studie s evolokumabem prokázaly vedle očekávané robustní redukce hladiny LDL-cholesterolu (LDL-C) i redukci nutnosti revaskularizace [1] i redukci klinických příhod [2].
Otázkou je, jaký je morfologický substrát těchto změn, tj. jaké změny aterosklerotických plátů k těmto klinickým výsledkům vedou. Následující přehled si klade za cíl popsat a okomentovat publikované studie s evolokumabem, které byly cíleny právě na morfologické změny aterosklerotických plátů.
Současné cíle v morfologickém hodnocení koronární aterosklerózy
Dosud nejužívanějším cílem v morfologickém hodnocení je stále objem aterosklerotického plátu, a to zejména ve své relativní podobě, jako tak zvaný percentuální objem plátu (PAV – Percent Atheroma Volume) vyjadřovaný v procentech. Ten vyjadřuje procento plochy tepny, které je obturováno aterosklerotickým plátem. Dalším užívaným vyjádřením objemu plátu je celkový objem plátu (TAV – Total Atheroma Volume) vyjadřovaným v mm3. Tato hodnota je však obtížně srovnatelná, neboť je závislá na délce plátu, a proto je často indexována na délku plátu (TAVi – index vyjadřovaný jako mm3/mm, tj. mm2), nebo normalizovaná na průměrný počet měření ve studii (TAVnorm). Důvodem přetrvávající preference tohoto parametru je jeho standardizované měření, a tím i jednoduché srovnání se staršími pracemi. Dalším velmi důležitým faktorem je prokázaný vztah mezi změnami objemu aterosklerotického plátu a výskytem koronárních příhod: je jednoznačně prokázáno, že objem aterosklerotického plátu koreluje s výskytem koronárních příhod, a redukce jeho objemu vede rovněž k redukci těchto příhod [3,4].

Dalšími často sledovanými parametry jsou morfologické charakteristiky nestabilního aterosklerotického plátu, o kterých je známo, že jsou rizikovými faktory vzniku akutního koronárního syndromu (ACS – Acute Coronary Syndrome). Jsou to:
• vysoké zastoupení nekrotické tkáně (> 10 %)
• tenká fibrózní čepička přes lipidové jádro (< 65 μm)
• vysoké zastoupení lipidů
• infiltrace plátu makrofágy
• novotvorba vasa plaquorum
• excentricita plátu
• pozitivní remodelace cévy v místě plátu
• vysoké napětí v plátu (obr. 1)
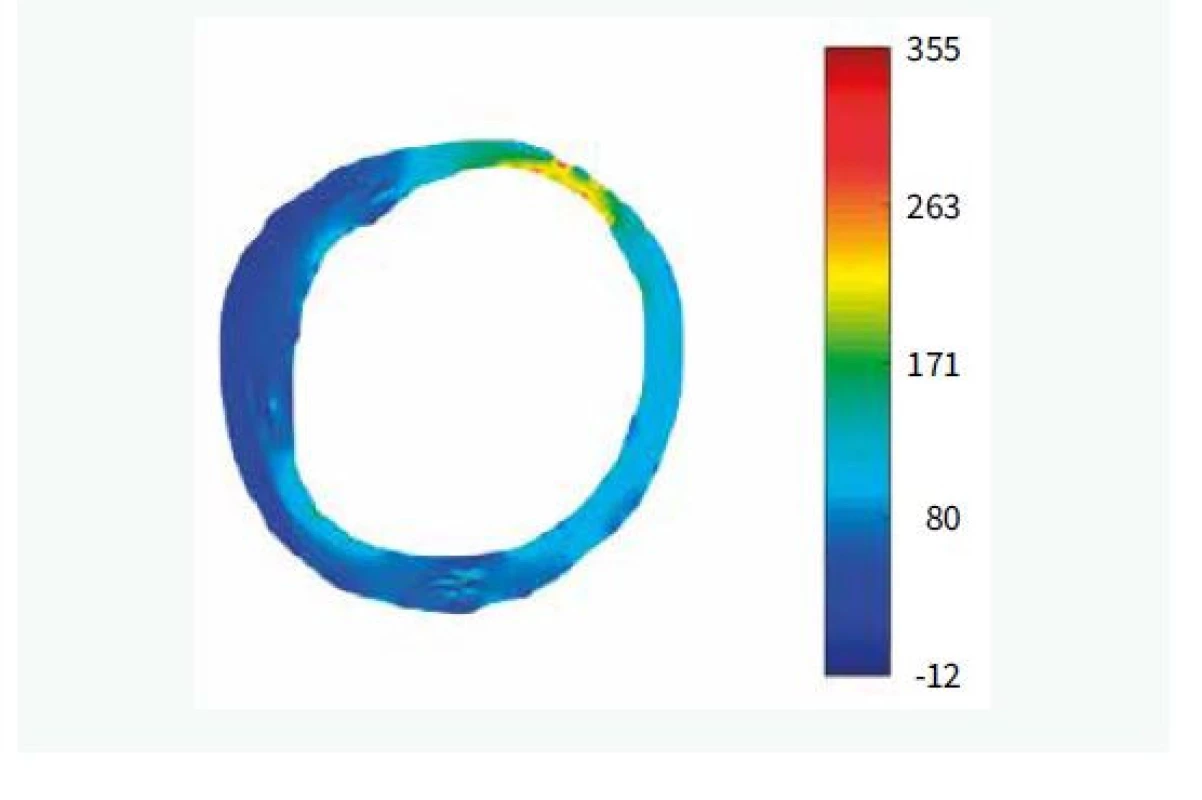
V krátkosti můžeme říci, že nestabilní aterosklerotický plát se vyznačuje vysokým zastoupením lipidové tkáně, která je díky aktivitě zánětlivého procesu přeměňována na nekrotickou tkáň, která posléze kalcifikuje. Aktivita zánětu může být patrna rovněž z vysokého zastoupení makrofágů na hranici mezi lipidovým jádrem a fibrózní čepičkou. Enzymy uvolňované zánětlivými buňkami rovněž vedou k zeslabování fibrózní tkáně (tzv. čepičky) překrývající lipidové jádro, čímž se zvyšuje riziko ruptury. Vysoká aktivita zánětu rovněž stimuluje novotvorbu drobných arteriol zvaných vasa plaquorum, které jsou poté zdrojem buněk a metabolických substrátů pro aktivní plát. Pro svou fragilitu však rovněž mohou být zdrojem krvácení do plátu, které vede k rychlé progresi stenózy, a rovněž mohou být morfologickým podkladem akutního koronárního syndromu. Tento typ plátu často vzniká excentricky na jedné straně cévy (často na vnitřní straně zakřivení tepny a na protilehlé straně, než jsou odstupující větve), což je dáno tím, že pláty vznikají spíše tam, kde je nižší smykové tření proudící krve (tzv. wall shear stress). Tepna na nárůst plátu reaguje zvětšením svého obejmu, aby plocha lumen zůstala zachována i přes nárůst objemu plátu. Jedná se o tak zvanou pozitivní remodelaci. Procesy umožňující toto zvětšení tepny ovšem současně vedou k oslabování fibrózní čepičky. Tyto výše popsané jevy vedou ve svém důsledku k nárůstu napětí v cévní stěně, které je pak rizikovým faktorem vzniku ruptury plátu.
O těchto patofyziologických procesech rozvoje aterosklerotického plátu se zmiňujeme z toho důvodu, že je všechny lze diagnostikovat a rovněž kvantifikovat pomocí zobrazovacích metod.
Zobrazovací metody
Objemy aterosklerotického plátu či cév a rovněž tak měření cévní remodelace jsou nejpřesněji stanovitelné pomocí intravaskulární ultrasonografie (IVUS – IntraVascular UltraSonography). Složení aterosklerotického plátu bylo nejčastěji hodnoceno pomocí technologie, která vychází z vyšetření IVUS, a to virtuální histologie (IVUS-VH). Nicméně od této metody se nyní spíše upouští pro její malou přesnost. Naopak velmi přesnou technologií v hodnocení zastoupení lipidové tkáně je spektroskopie za použití vlnových délek blízkých infračervenému světlu (NIRS – Near Infra-Red Spectroscopy), která je v klinické praxi používána ve spojení s IVUS-sondou. Při jednom vyšetření tak lze měřit objemy plátů i zastoupení lipidové tkáně. Podobnou, i když zatím jen experimentální metodou je analýza nekrotické tkáně pomocí intravaskulární fluoroskopie (NIRAF – Near-InfraRed AutoFluorescence). Velmi používanou technikou je dnes optická koherentní tomografie (OCT – Optical Coherence Tomography), pomocí které lze měřit sílu fibrózní čepičky (FCT – Fibrous Cap Thickness), detekovat lipidovou tkáň, eroze či rupturu plátu, makrofágy i vasa plaquorum.
Morfologické studie s evolokumabem
Po tomto krátkém přehledu bychom nyní rádi okomentovali výsledky studií s inhibitorem proprotein konvertázy subtilizin/ kexin typu 9 (PCSK9i) evolokumabem.
Studie GLAGOV
Studie GLAGOV [6] (Global Assessment of Plaque Regression With a PCSK9 Antibody as Measured by Intravascular Ultrasound) si dala za cíl zhodnotit vliv evolokumabu na objem a složení aterosklerotických plátů v koronárních tepnách. Detailní komentář studie GLAGOV jsme publikovali již dříve [7], proto nyní podáváme jen zkrácený komentář.
Do studie byli zařazeni pacienti s ischemickou chorobou srdeční, a to jak se stabilní anginou pectoris, tak s akutním koronárním syndromem (nestabilní angina pectoris a infarkt myokardu bez ST-elevací), kteří absolvovali klinicky indikovanou selektivní koronarografii.
Primárním cílem studie byla absolutní změna PAV, jako sekundární cíl byl zvolen absolutní rozdíl v TAVnorm. Do studie bylo randomizováno 970 pacientů. Ve větvi s evolokumabem došlo k redukci PAV o 0,95 %, zatímco v placebové větvi došlo k progresi PAV o 0,05 %. Tento rozdíl byl statisticky vysoce významný (CI 95%: -1,8 až -0,64 %; p < 0,001).
Sekundárním cílem byl rozdíl v absolutním objemu plátu – TAVnorm. U pacientů léčených evolokumabem v kombinaci se statiny došlo k jeho poklesu o 5,8 mm3, zatímco ve skupině léčených pouze statiny došlo k jeho progresi o 0,9 mm3. Tento rozdíl byl opět statisticky vysoce významný (p < 0,001).
Autoři studie předpokládali, že při dosažení cílové hladiny LDL-C < 1 mmol/l dojde ke zmenšení PAV odhadem o 2 %. Výsledek však byl výrazně menší (redukce PAV o 0,95 %). Větší regrese plátů (redukce PAV o 1,97 %, výskyt redukce PAV u 81,3 % pacientů) byla zaznamenána u podskupiny pacientů, kteří měli vstupní LDL-C < 1,8 mmol/l. Vysvětlením tohoto, na první pohled nelogického, nálezu je známý fakt, že pacienti s nižší hladinou vstupního cholesterolu bývají často ti, kteří jsou již léčeni pro manifestní projevy aterosklerózy. Jejich nízká hladina cholesterolu je tak výrazem dobré léčby, a nikoliv nízkého rizika.
Ve studii GLAGOV byla rovněž hodnocena změna složení aterosklerotických plátů, a to pomocí virtuální histologie. V této podstudii bylo analyzováno celkem 331 pacientů. Největší pozornost byla zaměřena na změnu zastoupení nekrotické tkáně. Její absolutní objem byl v obou skupinách snížen (-0,1 ± 0,5 mm3 vs -0,6 ± 0,5 mm3; p = 0,49), ale její relativní zastoupení v obou skupinách vzrostlo (+0,4 ± 0,5 % vs 0,9 ± 0,6 %; p = 0,67). Tento zdánlivý rozpor je dán tím, že ostatní sledované tkáně plátu (fibrózní a fibrolipidová) byly redukovány více, takže ve zmenšeném plátu bylo zaznamenáno zvýšené relativní zastoupení nekrotické tkáně, byť její absolutní množství bylo rovněž sníženo. Narůst nejen relativního, ale i absolutního zastoupení nekrotické tkáně v plátech byl popsán i ve studiích se statinovou monoterapií [8–10]. Zajímavým zjištěním je významná korelace mezi změnou hladiny C-reaktivního proteinu a změnou jak absolutního, tak relativního zastoupení nekrotické tkáně v plátu (p = 0,04). Tento fakt odráží vznik nekrotické tkáně z lipidové chronickým zánětlivým procesem.
Tkání, která progredovala jak v absolutním, tak v relativním měřítku, byly kalcifikace (+ 0,6 ± 0,3 mm3 vs 1,0 ± 0,3 mm3; p = 0,49 a +1,0 ± 0,4 % vs + 2,2 ± 0,4 %; p = 0,1). Studie potvrdila vztah mezi redukcí LDL-C (a méně rovněž i mezi snížením objemu plátu) a vyšším zastoupením kalcifikací v plátech. Stejný jev, tedy navýšení kalcifikací v plátech při hypolipidemické terapii, byl popsán i ve studiích se statiny v monoterapii [11,9], a rovněž tak při duální terapii statiny s ezetimibem [12]. Vzhledem k výrazné redukci klinických příhod při terapii jak statiny v monoterapii, tak statiny v kombinaci s evolokumabem, je toto zvýšení kalcia v plátech nejspíše projevem stabilizace plátu, a nikoliv jeho progrese.
Jednou z málo známých limitací této studie je fakt, že k analýze virtuální histologie byla použita 45MHz sonda Revolution. Jde o to, že pro získání informace o složení plátů používá virtuální histologie spektrální analýzu odraženého ultrasonografického signálu [13].
Zjednodušeně lze říci, že klasický černobílý ultrasonografický (USG) obraz vzniká na základě amplitudy odraženého signálu, velká amplituda je kódována bílou a malá černou barvou. Bylo však prokázáno, že frekvence odraženého USG-signálu odpovídají tkáni, od které se USG-signál odrazil. To následně umožňuje analýzu složení plátů. Skupina vedená G. Vincem, která tuto analýzu prováděla, uspěla až při použití elektronické (nerotační) USG-sondy používající USG-signál o frekvenci 20 MHz. Jde o to, že se mechanická (rotační) sonda používající vyšší frekvence (40–45 MHz) pohybuje v katétru, aby svou rotací nepoškodila intimu. Tato rotace však vytváří tření, které mění spektrální složení odraženého USG-signálu, a to ještě navíc nekonstantním způsobem. Výsledná spektrální analýza je tak vždy odlišná, a to i při opakovaném vyšetřování téhož plátu. Proto byla pro vytvoření virtuální histologie nakonec použita sonda elektronická, která nerotuje, a není tak zatížena touto technickou limitací. Je proto možné, že negativní výsledky studie jsou dány použitím neadekvátní sondy.
Vliv evolokumabu na změnu síly fibrózní čepičky a zastoupení makrofágů v plátech
Autoři Yano et al [14] publikovali studii hodnotící změnu síly fibrózní čepičky a zastoupení makrofágů v plátech u nemocných bezprostředně po ACS. Jedná se o menší nerandomizovanou retrospektivní observační studii, která zařadila 64 nemocných, kteří kromě léze způsobující ACS (tzv. culprit léze) ještě měli další léze, z nichž alespoň jedna nebyla hemodynamicky významná a byla vhodná k OCT-vyšetření. Všichni pacienti byli léčeni rosuvastatinem v dávce 5 mg a 20 pacientů (těch co souhlasili s doplatkem za léčbu) bylo léčeno evolokumabem v dávce 140 mg každé dva týdny po dobu 3 měsíců. Studii dokončilo 58 pacientů, z nichž 40 mělo provedeno OCT již vstupně, a pak všichni OCT za jeden měsíc, a poté za 3 měsíce od zahájení studie. Při OCT-hodnocení byla hodnocena síla fibrózní čepičky (vybrán jeden řez s nejmenším rozměrem fibrózní čepičky), úhel lipidové tkáně, tj. jaký úhel z celkových 360 stupňů tepny zabírá lipidová tkáň (vybrán jeden řez s největším úhlem lipidové tkáně), byla změřena délka segmentu obsahujícího lipidovou tkáň a bylo provedeno semikvantitativní hodnocení zastoupení makrofágů (vybrán jeden řez s maximálním množstvím makrofágů).
Studie prokázala výrazně vyšší redukci LDL-C ve skupině léčené evolokumabem ve srovnání se statinovou monoterapií (redukce o 74,5 % vs o 38,4 %; p < 0,001). Při hodnocení OCT nálezů byla prokázána redukce úhlu lipidů a semikvantitativního hodnocení obsahu makrofágů. Dále došlo k nárůstu fibrózní čepičky. Ve všech ukazatelích byl patrný významný rozdíl mezi vstupním vyšetřením a měsíční kontrolou, stejně tak jako mezi měsíční a 3měsíční kontrolou. Ve všech zmíněných ukazatelích byly změny výraznější pro pacienty léčené evolokumabem. Autoři rovněž popisují lineární korelaci mezi redukcí LDL-C a nárůstem síly fibrózní čepičky. Při hodnocení délky lipidů bylo zjištěno významné zkrácení (z 8,4 mm na 8,0 mm) mezi měsíční a 3měsíční kontrolou ve skupině léčené evolokumabem.
Ponecháme-li stranou problematický design studie (nerandomizovaná studie s inherentním bias pro pacienty s lepším sociálním zázemím a vyšším zájmem o své zdraví), je třeba upozornit na několik technických úskalí takovéhoto hodnocení. Předně je velmi nesnadné až nemožné nalézt stejný řez ve vstupním a kontrolním vyšetření, neboť jeden řez odpovídá 0,2 mm. Navíc zobrazení tepny je rovněž ovlivněno polohou sondy v lumen, která nemusí být stejná během vstupního a kontrolního vyšetření. Měření nejmenšího rozměru je problematické, neboť měření takto malých rozměrů je při OCT obtížné (software je primárně určen na měření velikosti lumen a tepny, tedy rozměrů o dva řády větších) a určení polohy měření je čistě subjektivní, neboť někdy i delší úseky obvodu plátu mohou stran síly fibrózní čepičky vypadat velmi podobně. Autoři nepodávají inter - a intraindividuální variabilitu měření, která (jak z vlastní zkušenosti víme) může být až v desítkách procent takovýchto měření. Autoři zvolili neobvyklý design studie se třemi OCT-vyšetřeními, což je velmi pracné, a je nutno jim za tuto volbu jednoznačně pogratulovat. Nicméně při hodnocení těchto výsledků je ale zarážející, že síla fibrózní čepičky vzrostla mezi vstupním vyšetřením a měsíční kontrolou (ve skupině s evolokumabem je to o 26 % a ve skupině se statinovou monoterapií o 17 %) a mezi měsíční a 3měsíční kontrolou to pak bylo o 14 % a 11 %. Tedy jako by nárůst síly fibrózní čepičky zpomaloval. To by mohlo odpovídat rychlé změně na počátku terapie, která je pak již méně výrazná. Ovšem změny největšího lipidového úhlu se chovají obráceně, zde je redukce mezi vstupním vyšetřením a 1měsíční kontrolou v evolokumabové skupině 14 % a ve statinové 7 %, a mezi měsíční a 3měsíční kontrolou je redukce 17 % a 11 %. Tedy jako by redukce lipidů zrychlovala až po měsíci. Samozřejmě, redukce lipidů může být děj, který je pomalejší než nárůst fibrózní tkáně. Ta by ale spíše (podle našeho názoru) měla kopírovat změnu lipidů, takže se hypoteticky spíše jedná o menší přesnost v provedených měřeních než reálný fakt.
Vedle přesnosti měření má výše popsaná technika ještě jeden problém, a to zásadnější. Je bodové měření rizikového faktoru skutečně reprezentativní pro odhad vzniku klinického fenoménu, tj. rozvoje akutního koronárního syndromu? Je velmi malá síla fibrózní čepičky v jednom bodě více riziková, než o něco silnější, ale stále malá fibrózní čepička zaujímající několik čtverečních milimetrů plátu? A pokud ano, kde je hranice rizikové plochy těchto parametrů? Hraje roli lokalizace takovéhoto plátu ve vztahu ke vzdálenosti od ostia, či ve vztahu k cirkumferenci tepny (vnitřní vs vnější strana tepny)? Domníváme se, že tyto otázky jsou ve vztahu k analýze rizikového profilu plátu zcela legitimní. Výše uvedená studie však na ně nepřináší žádnou odpověď.
Uvedené analýzy ovšem provézt lze. Je ale nutné provádět mnohem sofistikovanější analýzu za použití semiautomatického softwaru [15]. Popis systému je nad rámec tohoto sdělení. V krátkosti lze říci, že se jedná o semiautomatický systém, který za použití umělé inteligence analyzuje zastoupení lipidů v plátu a sílu fibrózní čepičky. Automatickou analýzu je vždy třeba ještě manuálně opravovat, nicméně právě díky použití umělé inteligence se systém sám učí ze svých chyb a další analýzy již provádí přesněji a manuální korekce je tak stále méně potřebná. Tento způsob dramaticky zvyšuje významnost měření, neboť místo jednoho či tří měření v daném řezu (jak je nejčastější používáno v různých studiích) analyzuje systém sledované parametry v celém měřeném rozsahu, a to v čase, který odpovídá standardnímu limitovanému měření. Pouze jako demonstraci možností předkládáme příklad semiautomatické analýzu FCT (obr. 2), z ní vyplývající 2D-analýzu (obr. 3) a následně 3D-rekonstrukci (obr. 4). Zobrazeným měřením je analýza FCT, ale stejným způsobem lze analyzovat přítomnost lipidových plátů, jejich rozsah či sledovat rozsah zastoupení rizikového fenotypu plátu (např. fibroateromu s tenkou fibrózní čepičkou). Tento software byl vyvinut na The University of Iowa, Iowa City, Iowa, USA ve spolupráci s II. interní klinikou VFN a 1. LF UK v Praze a Kardiologickou klinikou na Lyola University Medical Center, Maywood, Illinois, USA.
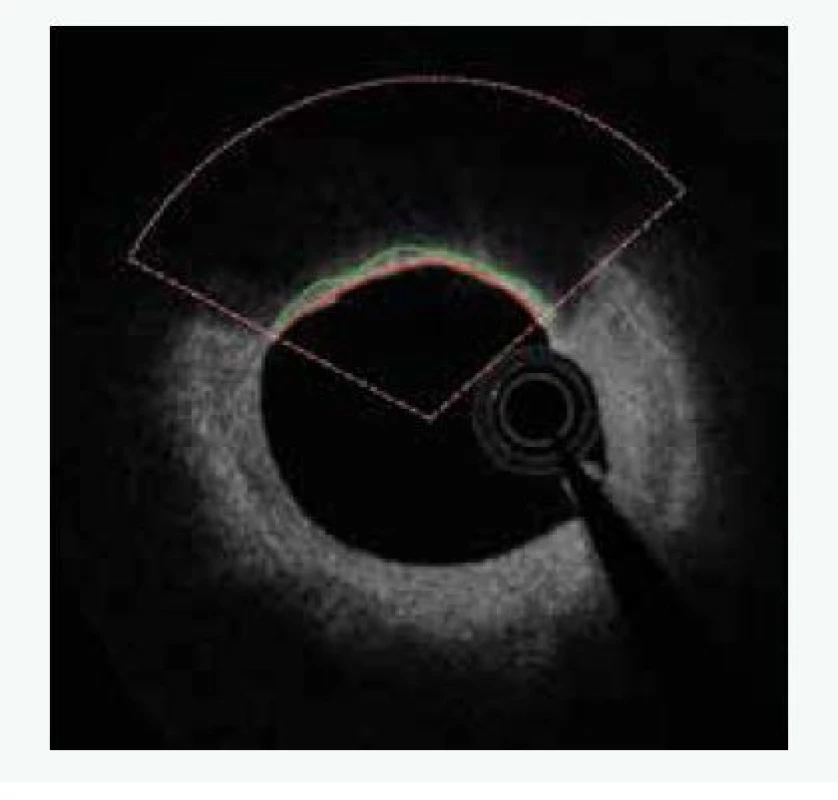
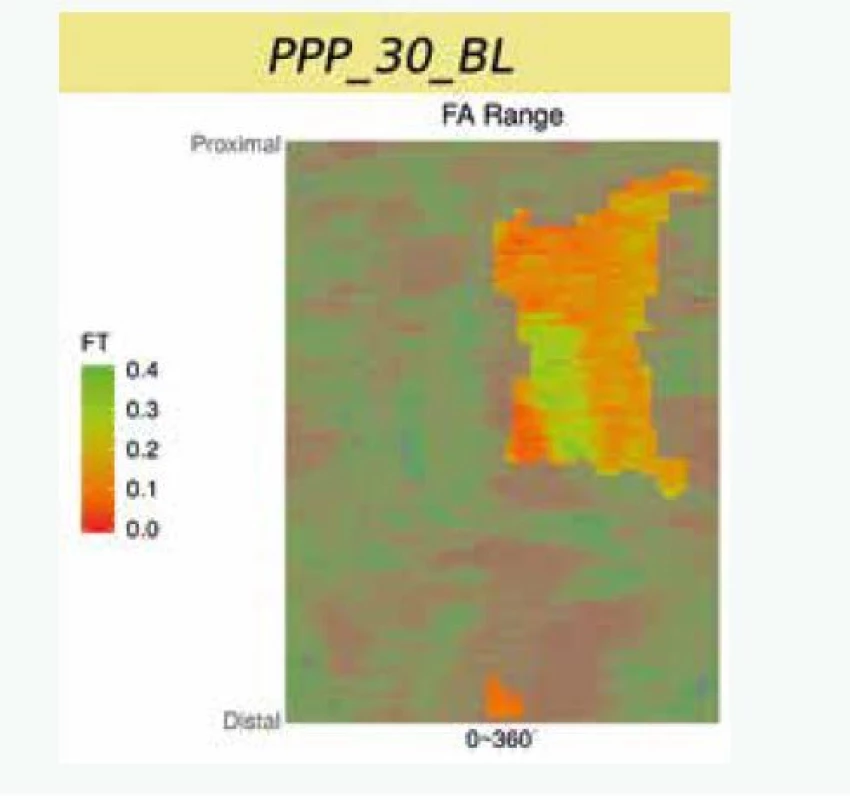

Studie HUGYENS
Studie [16] si dala za cíl prokázat změny aterosklerotických plátů při hodnocení IVUS a OCT při terapii evolokumabem. Do studie byli zařazení pacienti s akutním koronárním syndromem typu infarktu myokardu bez ST-elevací (NSTEMI), kteří kromě culprit léze měli ještě jednu stenózu o rozsahu 20–50 % referenčního rozměru lumen (při angiografickém hodnocení). Autory studie bylo požadováno, aby kandidáti studie měli hladinu LDL-cholesterolu > 3,36 mmol/l (pokud neužívali statiny), > 2,07 mmol/l (pokud užívali nižší nebo střední dávky statinů), anebo > 1,55 mmol/l (pokud užívali vysokou dávku statinů). Další podmínkou zařazení do studie byl nález fibrózní čepičky se šíří < 120 μm alespoň u jednoho řezu (v rámci vyšetřované léze) a lipidového plátu s rozsahem lipidů > 90 % obvodu tepny, opět alespoň v jednom řezu. Zvažovaný segment tepny musel být dlouhý alespoň 40 mm. Vylučovacími kritérii byly: renální insuficience s glomerulární filtrací < 30 ml/min/1,73 m2, statinová intolerance, nebo předchozí užívání PCSK9 inhibitorů. Pacienti byli randomizováni v poměru 1 : 1 k evolokumabu v dávce 420 mg jednou měsíčně po dobu 48 týdnů, nebo k placebu. Všichni pacienti užívali statiny.
Pro morfologické hodnocení pomocí IVUS a OCT byl použit alespoň 40 mm dlouhý úsek, který byl hodnocen po 0,5 mm při IVUS vyšetření a po 0,2 mm při OCT vyšetření (technická poznámka: Při OCT byla použita rychlost posunu sondy 36 ml/s a snímkovací frekvence 180 snímků za sekundu, vzdálenost 0,2 mm tedy odpovídá hodnocení každého jednotlivého řezu získaného při vyšetření. Jedná se tedy o velmi detailní studii). Při IVUS vyšetření byla v každém měřeném úseku hodnocena plocha lumen a plocha tepny, z nichž byly pro celý vyšetřený segment kalkulovány PAV a TAVnorm. Při OCT-vyšetření byly v každém měřeném úseku, který obsahoval plát, hodnoceny: FCT, úhel, který zaujímá lipidový plát, dále bylo provedeno semikvantitativní hodnocení přítomnosti makrofágů, kalcifikací a mikrovaskularizace (vasa plaquorum).
Studii dokončilo 161 pacientů. Výsledná hladina cholesterolu byla logicky výrazně nižší v evolokumabové skupině než ve skupině placebové (0,72 mmol/l vs 2,25 mmol/l; p < 0,001), rovněž tak došlo k významně větší redukci hladiny Lp(a): -24 nmol/l vs -4,1 nmol/l (p = 0,003). OCT-nálezy byly hodnoceny u 119 pacientů. V evolokumabové skupině došlo k významně vyššímu nárůstu minimální síly fibrózní čepičky (o 39 μm vs 22 μm; p = 0,015), což byl nárůst o 80,5 %, resp. 44,9 % (p = 0,04). Maximální úhel lipidů se snížil o 51 stupňů vs 25 stupňů (p = 0,04). Autoři rovněž dokládají vysokou interindividuální i intraindividuální shodu v měření FCT (kappa > 0,92) a rovněž tak úhlu lipidů (kappa > 0,98). Z explorativních cílů je popisována redukce indexu přítomnosti makrofágů (celková délka tepny obsahující makrofágy v plátech): -3,17 vs -1,45 (p = 0,04), nevýznamná redukce vasa plaquorum: -0,06 vs 0,35 (p = 0,35) a progrese úhlu kalcifikací v obou větvích: 2,9 stupňů vs 4,6 stupňů (p = 0,49).
Studie rovněž hodnotila změnu PAV pomocí intravaskulární USG. Tato analýza byla provedena u 79 probandů. Regrese plátů byla prokázána v obou skupinách, přičemž u pacientů léčených evolokumabem byla signifikantně větší, v těchto případech PAV poklesl o 2,29 % a v placebové větvi o 0,61 % (p = 0,009).
Studie nebyla designována pro hodnocení klinických příhod, nicméně výše popsané morfologické změny naznačily svůj možný klinický dopad, když v evolokumabové skupině byl zaznamenán numericky nižší výskyt infarktu myokardu ve srovnání s placebovou skupinou (0 % vs 3,7 %) a rovněž nižší mortalita (0 % vs 1,2 %). Rozdíly nejsou statisticky významné, ale ukazují na vztah mezi morfologickými změnami nalezenými v plátech a jejich klinickým dopadem.
Studie HUYGENS tedy přináší data o stabilizaci plátu při terapii evolokumabem u nemocných léčených pro NSTEMI a potvrzuje tak data ze studie autorů Yano et al diskutovanou výše [14].
Studie znovu potvrdila hypotézu „čím níže, tím lépe“, podle níž je patrný kontinuálně narůstající benefit ve smyslu snížení rizikových rysů aterosklerotických plátů se snižující se hladinou LDL-C. U pacientů s cílovou hladinou LDL-C < 0,75 mmol/l byla hodnota FCT < 65 μm (nalezená alespoň v jednom řezu) jen u 12,5 % nemocných. Rovněž byl prokázán lineární vztah mezi dosaženým, cílovým LDL-C a nárůstem FCT. Zajímavým zjištěním je, že k nárůstu FCT začíná docházet až po poklesu hladiny LDL-C o 70 %, což samozřejmě přináší otázku, zda nebude třeba zvýšit doporučovanou 50% redukci LDL-C v sekundární prevenci k vyšším hodnotám.
Nárůst FCT a redukce množství lipidů v plátu byly rovněž prokázány při terapii alirokumabem ve studii autorů Gao F et al [17]. Nárůst FCT byl v této studii numericky nižší, než je udáván ve studii HUYGENS, ovšem dosažená hladina LDL-C byla rovněž nižší (1,32 mmol/l). K možnému srovnání evolokumabu a alirokumabu na změny rizikových charakteristik plátu jistě přispějí právě probíhající studie s alirokumabem PACMAN-AMI [18] a ALTAIR [19].
Dosažená regrese plátu s průměrnou hodnotou redukce PAV o 2,29 % velmi dobře odpovídá predikované regresi na základě dosažené cílové hodnoty LDL-C. Tento výsledek je výrazně lepší než ten, který byl dosažen ve studii GLAGOV, což je nejspíše dáno sledováním pacientů s ACS (kteří mají více metabolicky aktivní pláty) a rovněž i analýzou větších plátů (průměrná hodnota PAV byla ve studii GLAGOV 36 % a ve studii HYUGENS 45 %).
Studie HUYGENS rovněž ukázala význam zahájení podávání evolokumabu krátce od vzniku akutního koronárního syndromu. Tento fakt je důležitý zejména proto, že z mnoha jiných studií víme, že v okamžiku vzniku ACS dochází k destabilizaci (tj. rizikovému zvýšení profilu) u řady dalších plátů, které nejsou morfologickým podkladem vzniku ACS [20]. Stále však není jasné, s jakou rychlostí dochází k výše uvedeným morfologickým změnám v aterosklerotických plátech po zahájení hypolipidemické terapie a rovněž to, zda se tyto morfologické změny vyvíjejí lineárně po celou dobu hypolipidemické léčby, nebo zda dojde k rychlé změně na začátku terapie a další změny jsou již pomalejší. To je jistě spíše úkolem experimentálních studií. Nicméně existuje studie, která prokázala významné změny v plátech již po 5týdenní terapii modifikovanými fosfolipidy (apoA1 Milano) [21].
Závěr
Závěrem je možno shrnout, že studie s evolokumabem, které používaly morfologické metody (IVUS a OCT) ke zhodnocení změn aterosklerotických plátů, prokázaly jednak zmenšení velikosti plátů, jak odpovídá dosažené cílové hodnotě LDL-C a dále snížení rizikového profilu plátů. Stále ovšem není jasné, který z rizikových faktorů je spojen se vznikem ACS nejvíce. Je nutno si uvědomit že v naprosté většině studií využívajících IVUS nebo OCT byly hodnoceny tzv. non-culprit pláty a zařazovacím kritériem bývá PAV < 50 %, takže hodnotíme spíše menší pláty, které nezpůsobují ACS. Zda uvedená zjištění platí i pro tzv. culprit pláty a pláty s větším objemem, není zcela jasné.
Jednou z hlavních limitací těchto studií je sledování rizikových faktorů v omezeném prostorovém rozsahu (často jen v několika bodech v celém rozsahu vyšetřené tepny, což je dáno pracností těchto měření. Časová náročnost i těchto zjednodušených měření představuje 2–3 hodiny práce na jednoho pacienta. To pak neumožňuje skutečně validní analýzu, neboť plná analýza sledovaných ukazatelů v celém rozsahu vyšetřené cévy by trvala stovky hodin manuální práce. Otázkou však je, zda nález rizikového parametru (např. FCT < 65 μm) v jednom bodě, či jednom řezu je skutečně rizikovým kritériem vzniku ACS. Pravděpodobnější se spíše jeví to, že výše popisované rizikové faktory plátu musí dosahovat určitých kritických zastoupení v plátu. K těmto hodnocením je však třeba použít 3D-analýzu vzniklou na základě mnohem více měření, než standardní studie používají. Stále častěji tak přichází ke slovu semiautomatické hodnocení plátu (automatické hodnocení s následnou manuální korekcí) za použití umělé inteligence (např. samostatná korekce automatické analýzy podle manuálních oprav), u níž je následná manuální korekce čím dál méně potřebná. Tento přístup generuje obrovské množství měření, ze kterých se pak již dá konstruovat realistický obraz tepny, který umožňuje volumetrické stanovení sledovaných ukazatelů. Na základě takovéto studie je pak množné hledat, které parametry – a zejména v jakém minimálním rozsahu – jsou skutečně zodpovědné za následný vznik ACS. V neposlední řadě je však třeba zdůraznit, že klinická příhoda je vždy důsledkem komplexních dějů a morfologický podklad je jen jednou z podmínek [22].
Dalšími podmínkami jsou pak aktuální stav celého vnitřního prostředí pacienta: aktuální rovnováha mezi prokoagulačními a fibrinolytickými systémy, rovnováha v hormonálním (úroveň stresových hormonů) a vegetativním (aktivita sympatiku vs parasympatiku) systému. Mimo úroveň současných možností poznání je pak vliv vyšších regulací nad těmito systémy (regulace z podkorových a zejména korových oblastí). To vše se pak odehrává v podmínkách individuální genetické predispozice ovlivněné navíc kontrolou genové transkripce na základě jak vnitřních, tak vnějších okolností. Proto lze očekávat ještě mnohá další překvapující odhalení na dobrodružné cestě za plným pochopením rozvoje (nejen) koronární aterosklerózy.
Tento článek vznikl za podpory společnosti Amgen, s.r.o. SC-CZ-AMG145-00681
Doručeno do redakce | Doručené do redakcie | Received 18. 9. 2022
Přijato po recenzi | Prijaté po recenzii | Accepted 20. 9. 2022
doc. MUDr. Tomáš Kovárník, Ph.D.
www.vfn.cz
Zdroje
1. Oyama K, Furtado R, Fagundes A et al. Effect of Evolocumab on Complex Coronary Requiring Revascularization. J Am Coll Cardiol 2021; 77(3): 259–267. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2020.11.011>.
2. Sabatine M, Giugliano R, Keech A et al. Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease. N Engl J Med 2017; 376(18): 1713–1722. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1615664>.
3. Nicholls SJ, Hsu A, Wolski K et al. Intravascular ultrasound-derived measures of coronary atherosclerotic plaque burden and clinical outcome. J Am Coll Cardiol 2010; 55(21): 2399–2407. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2010.02.026>.
4. Bhindi R, Guan M, Zhao Y et al. Coronary atheroma regression and adverse cardiac events: a systematic review and meta-regression analysis. Atherosclerosis 2019; 284 : 194–201. Dostupné z DOI: <http://dx.doi.org/10.1016/j.atherosclerosis.2019.03.005>.
5. Mintz GS, Garcia-Gracia HM, Nicholls SJ et al. Clinical expert consensus document on standards for acquisition, measurement and reporting of intravascular ultrasound regression/progression studies. Eurointervention 2011; 6(9): 1123–1130. Dostupné z DOI: <http://dx.doi.org/10.4244/EIJV6I9A195>.
6. Nicholls S, Puri R, Anderson T et al. Effect of Evolocumab on Progression of Coronary Disease in Statin-Treated Patients: The GLAGOV Randomized Clinical Trial. JAMA 2016; 316(22): 2373–2384. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.2016.16951>.
7. Kovárník T, Kopřiva K, Pudil J. Regrese koronární aterosklerózy a možnosti jejího zobrazení se zaměřením na výsledky studie GLAGOV. [Examination methods for coronary atherosclerosis regression with special focus on GLAGOV trial]. Vnitř Lék 2018; 64(1): 61–64.
8. Hougaard M, Hansen HS, Thayssen P et al. Influence of ezetimibe in addition to high-dose atorvastatin therapy on plaque composition in patients with ST-segment elevation myocardial infarction assessed by serial intravascular ultrasound with iMap: the OCTIVUS trial. Cardiovasc Revasc Med 2017; 18 : 110–117. Dostupné z DOI: <http://dx.doi.org/10.1016/j.carrev.2016.11.010>.
9. Nozue T, Yamamoto S, Tohyama S et al. Statin treatment for coronary artery plaque composition based on intravascular ultrasound radiofrequency data analysis. Am Heart J 2012; 163(2): 191–199.e1. Dostupné z DOI: <http://doi 10.1016/j.ahj.2011.11.004>.
10. Lee SWL, Hau WK, Kong SL et al. Virtual histology findings and effects of varying doses of atorvastatin on coronary plaque volume and composition in statin-naive patients – The VENUS study. Circ J 2012; 76(11): 2662–2672. Dostupné z DOI: <http://dx.doi.org/10.1253/circj.cj-12–0325>.
11. Puri R, Libby P, Nissen SE et al. Long-term effects of maximally intensive statin therapy on changes in coronary atheroma composition: insights from SATURN. Eur Heart J Cardiovasc Imaging 2014; 15(4): 380–388. Dostupné z DOI: <http://dx.doi.org/10.1093/ehjci/jet251>.
12. Kovarnik T, Mintz GS, Skalicka H et al. Virtual Histology Evaluation of Atherosclerosis Regression During Atorvastatin and Ezetimibe Administration. Circ J 2012; 76(1):176–183. Dostupné z DOI: <http://dx.doi.org/10.1253/circj.cj-11–0730>.
13. Nair A, Kuban BD, Tuzcu EM et al. Coronary plaque classification with intravascular ultrasound radiofrequency data analysis. Circulation 2002; 106(17): 2200–2206. Dostupné z DOI: <http://dx.doi.org/10.1161/01.cir.0000035654.18341.5e>.
14. Yano H, Horinaka S, Ishimitsu T. Effect of evolocumab therapy on coronary fibrous cap thickness assessed by optical coherence tomography in patients with acute coronary syndrome. J Cardiol 2020; 75(3): 289–295. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jjcc.2019.08.002>.
15. Kassis N, Kovarnik T, Chen Z et al. Fibrous Cap Thickness Predicts Stable Coronary Plaque Progression: Early Clinical Validation of a Semiautomated OCT Technology. JSCAI (Journal of the Society for Cardiovascular Angiography & Intervention) 2022. In press. Dostupné z DOI: <https://doi.org/10.1016/j.jscai.2022.100400>.
16. Nicholls S, Kataoka Y, Nissen S et al. Effect of Evolocumab on Coronary Plaque Phenotype and Burden in Statin-Treated Patients Following Myocardial Infarction. JACC Cardiovasc Imaging 2022; 15(7): 1308–1321. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jcmg.2022.03.002>.
17. Gao F, Wang ZJ, Ma XT et al. Effect of alirocumab on coronary plaque in patients with coronary artery disease assessed by optical coherence tomography. Lipids Health Dis 2021; 20(1): 106. Dostupné z DOI: <http://dx.doi.org/10.1186/s12944–021–01528–3>.
18. Zanchin Ch, Koskinas K, Ueki Y et al. Effects of the PCSK9 antibody alirocumab on coronary atherosclerosis in patients with acute myocardial infarction: a serial, multivessel, intravascular ultrasound, near-infrared spectroscopy and optical coherence tomography imaging study–Rationale and design of the PACMAN-AMI trial. Am Heart J 2021; 238 : 33–44. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ahj.2021.04.006>.
19. Otake H, Sugizaki Y, Toba T et al. Efficacy of alirocumab for reducing plaque vulnerability: Study protocol for ALTAIR, a randomized controlled trial in Japanese patients with coronary artery disease receiving rosuvastatin. J Cardiol 2019; 73(3): 228–232. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jjcc.2018.11.012>.
20. Rioufol G, Finet G, Ginon I et al. Multiple atherosclerotic plaque rupture in acute coronary syndrome a three-vessel intravascular ultrasound study. Circulation 2002; 106(4): 804–808. Dostupné z DOI: <http://dx.doi.org/10.1161/01.cir.0000025609.13806.31>. Retraction in Notice of retraction. Circulation 2012; 125(23): e1019. Dostupné z DOI: <http://dx.doi.org/10.1161/CIR.0b013e31825f643c>.
21. Nicholls S, Tuzcu M, Sipahi I et al. Relationship between atheroma regression and change in lumen size after infusion of Apolipoprotein A-I Milano. J Am Coll Cardiol 2006; 47 : 992–997.
22. Arbad-Zadeh A, Fuster V. From detecting the vulnerable plaque to managing the vulnerable patient. JACC 2019; 74(12): 1582–1593. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2019.07.062>.
Štítky
Angiologie Diabetologie Interní lékařství Kardiologie Praktické lékařství pro dospěléČlánek vyšel v časopise
Athero Review

2022 Číslo 3
Nejčtenější v tomto čísle
- Kyselina bempedová – nový lék ke snižování hladiny LDL-cholesterolu
- Novější možnosti zpomalení rozvoje chronického onemocnění ledvin a role dapagliflozinu
- Stanovisko ČSAT ke Konsenzu EAS 2021: Lipoproteiny bohaté na triglyceridy a jejich remnantní částice – přehled metabolizmu, role při aterosklerotickém kardiovaskulárním onemocnění a nové terapeutické strategie
- Profesor Zdeněk Zadák pětaosmdesátiletý!
