Význam mikroRNA v patofyziologii aterosklerózy a jejich možné klinické využití
Role of microRNAs in the pathophysiology of atherosclerosis and their potential clinical use
Atherosclerosis and its clinical manifestations (such as myocardial infarction or stroke) still remain the leading cause of death in developed countries. In recent decades our knowledge about the origin of atherosclerosis has considerably advanced; key molecules and signalling cascades involved in this complex process have been described, which enabled the development of effective therapeutic procedures that can moderate the effects of atherosclerosis on an individual's health. The discovery of non-coding RNAs (ncRNA) which participate in the regulation of gene expression and are involved in almost all the processes in the body, has revealed yet another level of complexity, it offers a new insight into the regulation of individual processes and, not least, also new procedures utilizable in diagnostics or therapy for atherosclerosis. This overview presents essential information about the function of microRNA, one of the ncRNA groups, and further discusses their involvement in the pathogenesis of atherosclerosis. The last part of the text provides an overview of possible uses of circulating microRNAs in diagnosing atherosclerosis and uses the results of animal as well as pilot human studies to also demonstrate the therapeutic potential which is hidden in these small molecules.
Key words:
circulating microRNA – diagnosing atherosclerosis – ncRNA – therapy for atherosclerosis
Autoři:
Jan Novák 1,2; Miroslav Souček 1
Působiště autorů:
II. interní klinika LF MU a FN U sv. Anny v Brně
1; Fyziologický ústav LF MU, Brno
2
Vyšlo v časopise:
AtheroRev 2016; 1(3): 144-150
Kategorie:
Přehledové práce
Souhrn
Ateroskleróza a její klinické manifestace (např. infarkt myokardu, či cévní mozková příhoda) v rozvinutých zemích stále představují vedoucí příčinu úmrtí. Během posledních dekád se naše znalosti o vzniku aterosklerózy výrazně posunuly kupředu: byly popsány klíčové molekuly a signální kaskády, které se tohoto komplexního procesu účastní, a to umožnilo vývoj efektivních terapeutických postupů, které dokážou zmírnit dopady aterosklerózy na zdraví jedince. Objev nekódujících RNA (ncRNA), které se podílejí na regulaci genové exprese a účastní se takřka všech procesů v našem těle, přináší další úroveň komplexnosti, nabízí nový náhled na regulaci jednotlivých procesů a v neposlední řadě i nové postupy využitelné v diagnostice či v terapii aterosklerózy. Tento přehledný referát předkládá základní informace o funkci mikroRNA, jedné ze skupin ncRNA, a následně se zaměřuje na jejich zapojení do patogeneze aterosklerózy. V poslední části textu podává přehled možného využití cirkulujících mikroRNA v diagnostice aterosklerózy a na výsledcích animálních a pilotních humánních studií demonstruje i možný terapeutický potenciál, který se v těchto malých molekulách skrývá.
Klíčová slova:
cirkulující mikroRNA – diagnostika aterosklerózy – ncRNA – terapie aterosklerózy
Úvod – ateroskleróza jako komplexní proces
Ateroskleróza představuje chronické komplexní onemocnění, během kterého dochází k ukládání lipidů do cévní stěny, jejímu chronickému zánětu a přestavbě, čímž dochází k změnám v krevním toku, ischemii tkání a orgánů a v případě akutního uzávěru cévy pak k urgentním stavům, které bezprostředně ohrožují život pacienta [1,2]. Klíčový význam v rozvoji aterosklerózy má cholesterol, který je v cirkulaci pro svou lipofilní povahu přenášen v lipoproteinových částicích. Odsun cholesterolu z periferních tkání do jater zajišťují lipoproteiny o vysoké hustotě (high density lipoproteins – HDL), dodávku do periferie pak lipoproteiny o nízké hustotě (low density lipoproteins – LDL) [1,2]. Oba procesy jsou za normálních okolností v rovnováze. Dojde-li ovšem k narušení cholesterolové homeostázy ve prospěch akumulace cholesterolu v periferních tkáních (např. cévách), je podpořen proces aterosklerózy. Laboratorně pozorujeme zvýšení hladin LDL-cholesterolu (LDL-C), či snížení hladin HDL-cholesterolu (HDL-C).
Narušení cholesterolové homeostázy pak spolu s lokálními změnami toku krve představují první kroky několikastupňového procesu vzniku aterosklerotického plátu. V místech změněného toku (zejména v bifurkacích) dochází k endotelové dysfunkci, endotel je více propustný a jeho buňky začínají vystavovat receptory, které usnadňují přestup bílých krvinek do cévní stěny a je aktivována signální kaskáda nukleárního faktoru kappa B (NFκB) [1–3]. Postupně vznikající zánět vede k alteraci v hladinách cytokinů, další změny toku se pak odrážejí na změně genové exprese nejen v endotelových, ale následně i hladkosvalových buňkách cévní stěny [4]. Hladkosvalové buňky přecházejí ze svého klidového kontraktilního fenopytu (nezbytného pro normální funkci cévy) do fenotypu proliferačního, dochází k remodelaci cévní stěny a dalšímu zrání aterosklerotických plátů [5].
mikroRNA (miRNA, miR), molekuly jež představí další odstavec, jsou zapojeny do všech výše zmíněných procesů. Dle osnovy nadnesené v tomto úvodu bude o zapojení vybraných miRNA do procesu aterosklerózy pojednáno v dalších odstavcích.
Nekódující RNA, mikroRNA a jejich funkce
Jedním z dlouho platných principů molekulární biologie je předpoklad, že deoxyribonukleová kyselina (deoxyribonucleic acid – DNA) slouží jako matrice pro vznik přenašečové ribonukleové kyseliny (messenger ribonucleic acid – RNA) a struktura mRNA je klíčem pro vznik bílkovin. mRNA jsou proto označovány jako kódující RNA, neboť ve své struktuře kódují strukturu bílkovin, které v buňkách plní řadu strukturálních a výkonných funkcí. Aby výše uvedený proces mohl úspěšně probíhat, je zapotřebí řada již desítky let známých nekódujících RNA – z nich uveďme např. ribosomální RNA (rRNA) nebo transferovou RNA (tRNA), které jsou nezbytné pro vznik ribosomů nebo pro přenos aminokyselin v průběhu proteosyntézy, ale žádné proteiny přitom nekódují [6].
Studie z posledních let využívající moderní molekulárně-biologické metody, které umožňují studium celého genomu a transkriptomu, tj. obsahu všech přepisovaných (transkribovaných) RNA v buňce, však ukazují, že zhruba dvě třetiny genomu jsou aktivně přepisovány a proteiny-kódující RNA přitom představují pouze cca 2 % z toho množství [7,8]. Zbývající molekuly RNA jsou označovány jako nekódující RNA (non-coding RNA – ncRNA) a dle jejich délky jsou rozdělovány na dvě základní skupiny – dlouhé nekódující RNA (long noncoding RNA – lncRNA) a malé nekódující RNA (small noncoding RNAs – sncRNA). sncRNA se obecně účastní regulace genové exprese a dle jejich specifických funkcí se poté dělí do celé řady podskupin (obr. 1A) [6,9].

mikroRNA (miRNA, miR) představují jednu ze skupin sncRNA – jedná se o krátké, přibližně 22 nukleotidů dlouhé úseky jednovláknové RNA, které negativně regulují genovou expresi na podkladě interference s cílovými mRNA, tj. těmi RNA, které kódují vznik bílkovin [10]. Dle všeobecně platného pravidla komplementarity (tj. že adenin se váže s uracilem a guanin se váže s cytosinem; A-U, C-G) se miRNA v komplexu s pomocnými proteiny vážou do specifických oblastí mRNA a svou vazbou vyvolají buď degradaci této mRNA, nebo zabrání překladu mRNA do bílkoviny – oba popisované mechanizmy způsobí, že proces genové exprese je zpomalen/zastaven a dojde ke snížení hladin bílkoviny, kterou cílová mRNA kódovala (obr. 1B).
Regulace pomocí miRNA je vysoce komplexní – jedna miRNA často cílí na více různých mRNA (mnohdy zapojených do jedné metabolické či signální kaskády) a jedna mRNA může být cílem pro více různých miRNA (obr. 1C), jako příklad vybrána miR-33 a přenašečový protein ABCA1 (ATP-binding cassette transporter A1), o jejichž významu bude pojednáno dále [11]. miRNA tímto způsobem působí jako citlivé regulátory genové exprese a narušení jejich hladin, popisované u řady onemocnění včetně aterosklerózy, má pak širokosáhlé dopady na řadu buněčných procesů. Může např. vyústit v urychlení proliferace (množení) či diferenciace (vyzrávání) buněk, může zcela změnit buněčný fenotyp, či může snížit expresi vybraných receptorů na povrchu buněk; v kontextu aterosklerózy se zmíněné procesy uplatní např. při vzniku aterosklerotického plátu, v remodelaci cévní stěny či regulaci metabolizmu lipoproteinů [11].
Posledním důležitým aspektem týkajícím se funkce miRNA je skutečnost, že miRNA nejsou limitovány ve své působnosti pouze na buňky, v nichž vznikají – buňky jsou schopny miRNA aktivně uvolňovat (ať již do malých membránových váčků, např. exosomů, nebo do pro aterosklerózu tak nezbytných lipoproteinových částic; obr. 1D) a předávat si je tak mezi sebou ve smyslu parakrinní či endokrinní komunikace [12]. miRNA vzniklá v játrech či v bílé krvince se tak např. může dostat do endotelových buněk, ovlivnit jejich genovou expresi, a tím urychlit či zpomalit proces aterosklerózy.
Pro možné klinické využití miRNA jsou pak důležitá zejména následující dvě fakta:
- hladiny miRNA jsme schopni ovlivnit s využitím uměle syntetizovaných molekul, což přináší nové terapeutické možnosti [13]
- miRNA vyskytující se v extracelulárním prostoru (krvi, plazmě, moči, slinách…) je možné vyizolovat a stanovit jejich hladiny (které se mění v přítomnosti nemoci, nebo při odpovědi na léčbu), což přináší nové diagnostické možnosti [12]
mikroRNA v patofyziologii aterosklerózy
mikroRNA a metabolizmus cholesterolu a lipoproteinů
SREBPs (sterol regulatory element binding proteins) představují již řadu let známé transkripční faktory, které přímo aktivují/inhibují expresi různých enzymů a signálních molekul zapojených do lipidového metabolizmu [14]. Při syntéze SREBPs vznikají i dvě miRNA, konkrétně miR-33a a miR-33b [15], které jsou uloženy v intronech genů pro SREBPs a podobně jako SREBPs i tyto dvě miRNA cílí na mRNA, které jsou přímo zapojeny do efluxu cholesterolu z jater/periferních tkání do nascentních HDL (např. transportér ABCA1 [15]), nebo které jsou důležité pro exkreci cholesterolu z jater do žluči (např. transportér ABCB11 [16]) a stejně tak cílí na řadu enzymů zapojených do syntézy mastných kyselin (např. CROT, FASN a další cíle), obr. 1C [11,15]. Byla již provedena řada studií na myších [17] i primátech [18], které ukazují, že blokádou miR-33 je možné zvýšit hladiny cirkulujícího HDL o 40–50%, aniž by HDL ztratilo své protizánětlivé vlastnosti a zároveň dochází ke zmenšení aterosklerotických plátů u pokusných zvířat [17,18]. Tyto efekty jsou pravděpodobně dány zvýšením exprese ABCA1 (a tím zvýšenou tvorbou HDL a vyšším „odsunem“ cholesterolu z periferie do jater), zvýšením exprese ABCB11 (a tím zvýšenou exkrecí cholesterolu do žluči) a v neposlední řadě recentní studie ukazují i na vliv blokády miR-33 na chování makrofágů a regulačních T-lymfocytů, které mají vlivem blokády miR-33 ateroprotektivní vlastnosti [19].
Kromě miR-33, která nepochybně představuje jeden z důležitých posttrankripčních uzlů regulujících metabolizmus cholesterolu, existují i další podobné miRNA; např. miR-27a přímo reguluje expresi transkripčních faktorů SREBP (a tím nepřímo miR-33 a všech jejích cílů) [20], je zapojena do syntézy apolipoproteinu B100 (apoB100) a má více než 9 dalších cílů přímo zapojených do metabolizmu cholesterolu [21]. Další miRNA (miR-223) tlumí expresi klíčového enzymu cholesterolové syntézy hydroxymethylglutaryl–koenzymA syntetázy a dále přímo snižuje hladiny scavangerového receptoru typu 1 třídy B (SRB1), který je nezbytný pro vychytávání HDL-částic [22]. miR-30c reguluje expresi genu MTTP (microsomal triglyceride transfer protein), jež je nezbytný pro loading lipidů do nascentního apoB, a tak i pro vznik částic o velmi nízké hustotě (very low density lipoproteins – VLDL) [23]. Recentní studie pak ukazují na význam miR-148a, která snižuje hladiny receptoru pro LDL (LDLR) a její blokáda pomocí specifických antagonistů způsobuje zvýšení clearance LDL v játrech [24].
Poslední zajímavostí, kterou v kontextu metabolizmu lipoproteinů a miRNA uvádíme, je i fakt, že zmiňovaná miR-223 je jednou z miRNA, které působí i mimo místo svého vzniku v jaterních buňkách – je také uschována v lipoproteinových částicích HDL (v LDL-frakci jsou její hladiny mnohem nižší) a z HDL dochází k jejímu transportu do endotelových buněk (ve kterých se tato miRNA za fyziologických okolností vůbec nevyskytuje) [25]. V endotelových buňkách pak miR-223 přímo snižuje expresi intracelulární adhezivní molekuly typu 1 (intracellular adhesion molecule 1 – ICAM-1), receptoru, který zajišťuje vazbu bílých krvinek na endotel a jejich přestup do cévní stěny – transfer miR-223 mezi HDL a endotelovými buňkami tak částečně vysvětluje dlouho známé anti-aterogenní působení HDL-molekul [25].
mikroRNA ovlivňující vznik a progresi aterosklerózy
Kromě miR-223 předávané do endotelových buněk z HDL regulují expresi ICAM-1, či E-selektinů miR-222, nebo miR-31 [26,27]. Pro endotelové buňky vysoce specifická miR-126 zase cílí na cévní adhezní molekulu (vascular cell adhesion molecule 1 – VCAM1) [28]. Terapeutické ovlivnění těchto miRNA by v budoucnu mohlo zabránit diapedéze leukocytů do cévní stěny, a tím utlumit aterosklerózu v jednom z jejích klíčových prvních kroků.
Jiné miRNA se podílejí na regulaci endoteliální zánětlivé odpovědi – v této hraje klíčovou roli signální dráha NFκB a např. miR-146a nebo miR-181b jsou jejími přímými inhibitory [29,30]. Intravenózní podání miR-181b pokusným zvířatům dokonce tlumí endoteliální zánětlivou odpověď a zmenšuje aterosklerotické léze, a tento efekt přitom není odvislý od změn v lipidovém spektru pokusných zvířat [29].
Krom zánětu se na rozvoji a progresi aterosklerózy dále podílejí změny v toku krve – v predilekčních místech cévního řečiště (bifurkace, zúžení) či na místech již vzniklých aterosklerotických plátů se laminární proudění (l-flow) mění v proudění turbulentní (tzv. d-flow, z angl. disturbed flow) [2]. Hladiny výše zmíněné miR-126 (konkrétně její varianty miR-126–5p) se vlivem d-flow snižují, čímž endotel přichází o její ateroprotektivní vlastnosti; podobně i artificiálně navozená blokáda této miRNA u pokusných zvířat, u nichž byly uměle navozeny endotelové léze, způsobila, že se tyto léze mnohem hůře hojily [31]. Hladiny celé řada dalších miRNA (např. miR-92a, miR-155, miR-663 a další) jsou tzv. „flow-dependentní“, tj. mění se s kvalitou proudění krve [4]. Krevní tok však neovlivňuje jen expresi miRNA v buňkách, ale ovlivňuje i obsah extracelulárních membránových váčků, které buňky produkují – laminární proudění způsobuje, že je již zmíněná miR-126 ve větší míře transportována z endotelových buněk do membránových váčků, které se tak dostávají do hladkosvalových buněk cévní stěny a udržují jejich kontraktilní fenotyp [31]. Podobně laminární proudění vede k uvolnění miR-143 a miR-145 do extracelulárních váčků, což má rovněž ateroprotektivní vlastnosti [32] – u myší deficientních pro miR-143/145 je kontraktilní funkce hladkosvalových buněk narušena, pokusná zvířata mají nižší tlak než kontrolní skupina a mnohem méně reagují na podání vazopresorů [33]. Navození zvýšené exprese miR-145 pomocí lentivirového vektoru naopak vede k zmenšení aterosklerotických lézí a k četným změnám jejich kvality – hromadí se v nich méně makrofágů, pláty mají menší nekrotické jádro a pevnější fibrinovou čepičku (a obecně vyšší obsah kolagenu) než pláty kontrolní skupiny [34].
Využití mikroRNA v diagnostice aterosklerózy a jejích komplikací
Cirkulující miRNA, tedy miRNA nacházející se v extracelulárním prostoru – plné krvi, plazmě, séru, ale i moči, slinách, potu, či mateřském mléce – byly poprvé popsány v roce 2008 [35]. Některé z těchto miRNA jsou do extracelulárního prostoru aktivně uvolňovány (jak bylo popsáno výše např. pro miR-126, miR-143/145, či miR-223), jiné se do oběhu dostávají např. při nekróze buněk (např. miR-499 při infarktu myokardu [36]). S ohledem na skutečnost, že některé miRNA vykazují tzv. tkáňovou/orgánovou specificitu (tj. jejich exprese v dané tkáni je 20krát vyšší než exprese v ostatních tkáních [37]), je pak možné vybrané miRNA teoreticky využít jako biomarkery poškození různých orgánů [38]. Možné využití miRNA jako diagnostických či prognostických markerů aterosklerózy a s aterosklerózou asociovaných nemocí ukazuje obr. 2 [2,39–41].
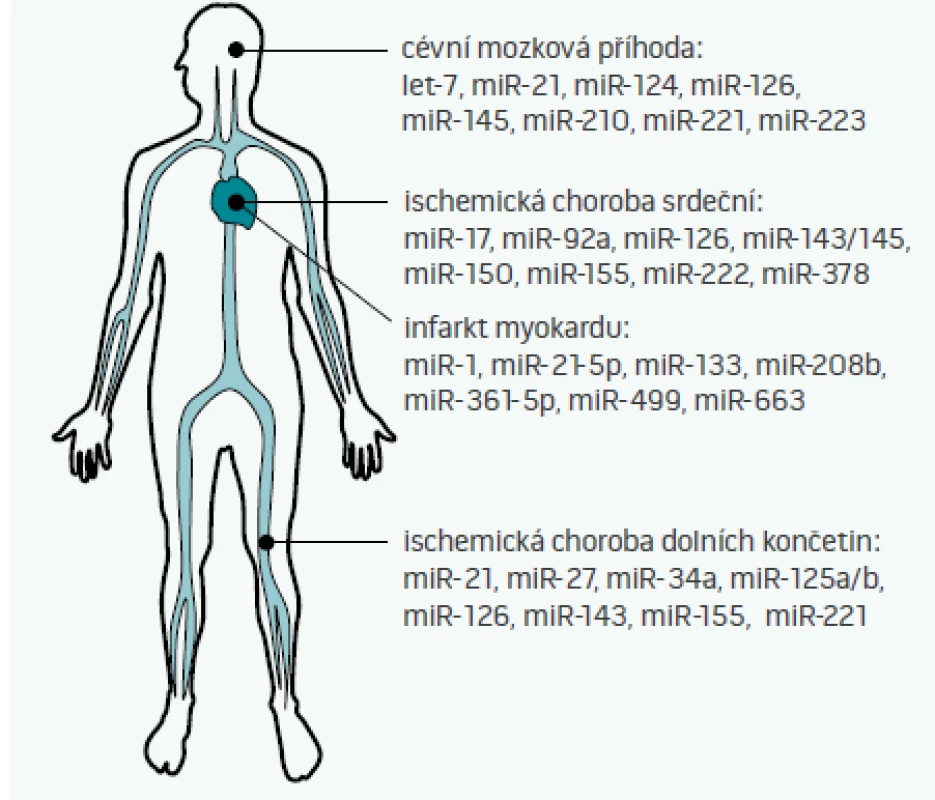
Studie věnující se diagnostice nemocí pomocí miRNA jsou nyní ve svých začátcích – většina studií je nyní limitována svým rozsahem (zejména malou velikostí vzorku), ale také volbou kontrolní vzorku (často jako kontrolní skupina vystupují zdraví jedinci, nikoliv pacienti s podobnými klinickými obtížemi). Velkým problémem pro porovnávání jednotlivých studií je i nedostatečná standardizace postupů mezi jednotlivými laboratořemi, problém ve stanovení hladin miRNA může nastat i v případě, že byl pacient před odběrem vzorků zaléčen heparinem, který inhibuje polymerázovou řetězovou reakci (PCR), která se využívá při stanovení hladin miRNA. Další nevýhodou stanovení miRNA oproti běžně užívaným biomarkerům je v současnosti i rychlost stanovení (trvají většinou několik hodin oproti desítkám minut u běžně užívaných biomarkerů). Zda se miRNA jako diagnostické markery v budoucnu uplatní, se tedy bude odvíjet od toho, zda budou tyto technické překážky odstraněny a zda nové miRNA-biomarkery přinesou nové informace (např. o pacientově prognóze), které současné biomarkery neposkytují [39].
Využití mikroRNA v terapii aterosklerózy?
Principy terapeutického ovlivnění miRNA jsou v podstatě dvojí: je-li některá z miRNA vlivem nemoci snížena, je naším cílem její hladiny substituovat (navýšit); jsou-li hladiny některé miRNA naopak zvýšeny, je cílem tyto hladiny snížit, ev. danou miRNA vyblokovat [13]. V animálních studiích jsou s výhodou využívány oba postupy, což nám blíže umožňuje pochopit význam jednotlivých miRNA u různých nemocí – příklady takového ovlivnění byly uvedeny výše např. pro miR-33, či miR-181a, jejichž modulace vedla k útlumu tvorby aterosklerotických plátů a regresi aterosklerózy. Na lidských subjektech jsme se zatím setkali v kontextu aterosklerózy a nekódujících RNA se dvěma léčivy – miravirsenem [42]a mipomersenem [43]. Miravirsen je oligonukleotid namířený přímo proti miR-122, což je jaterně specifická miRNA která udržuje expresi řady jaterně specifických genů. Zároveň je však nezbytná pro efektivní replikaci viru hepatitidy C a její blokádou pomocí miravirsenu se podařilo snížit virovou nálož u infikovaných osob a u části z nich nebyla virová RNA vůbec identifikovatelná; jako vedlejší výstup této studie bylo pozorováno snížení hladin cholesterolu u pokusných osob [42]. Mipomersen je pak oligonukleotid přímo namířený proti apoB (nejedná se tedy o přímou blokádu některé z miRNA, ale o využití jejich mechanizmu účinku), který snižuje hladiny LDL a dle recentních dat i výskyt kardiovaskulárních příhod u pacientů s familiární hypercholesterolemií [43].
Závěr
Nekódující RNA představují velice rozsáhlou skupinu molekul, jejichž pravý význam začínáme v posledních dvou až třech desetiletích postupně odkrývat. miRNA díky své všudypřítomnosti a velkému množství intra- i extracelulárních funkcí patří k jedné z nejatraktivnějších podskupin malých nekódujících RNA, které by v budoucnu mohly sloužit jako univerzální diagnostické sérové markery pro řadu různých nemocí, včetně aterosklerózy a jejích komplikací, ale také jako nové léčebné prostředky. Nelze očekávat, že během pár let miRNA nahradí běžně užívané markery (jako např. troponiny), nebo že v lékárnách najdeme infuze s miRNA-inhibitory, které okamžitě zvrátí počínající aterosklerózu nebo normalizují hladiny cholesterolu. Je také možné, že miRNA přestavují pouze „slepou větev“ výzkumu a za několik let, či desetiletí se objeví nové atraktivnější a bezpečnější molekuly. V současné době však miRNA představují nepochybně zajímavou skupinu molekul, která si zaslouží další zkoumání, a až další výzkum pak odhalí, jaký je jejich pravý klinický potenciál.
Práce vznikla v rámci projektu „Kardiovaskulární systém: od modelu přes terapii k prevenci“(MUNI/A/1365/2015) z prostředků na specifickývysokoškolský výzkum, kterou poskytlo MŠMT ČR v roce 2016.
MUDr. Jan Novák
jan.novak@fnusa.cz
II. interní klinika LF MU a FN u sv. Anny v Brně
www.fnusa.cz
Doručeno do redakce 12. 9. 2016
Přijato po recenzi 26. 9. 2016
Zdroje
1. Hansson GK, Libby P, Tabas I. Inflammation and plaque vulnerability. J Intern Med 2015; 278(5): 483–493. Dostupné z DOI: <http://dx.doi.org/10.1111/joim.12406>.
2. Feinberg MW, Moore KJ. MicroRNA Regulation of Atherosclerosis. Circ Res 2016; 118(4): 703–720. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCRESAHA.115.306300>.
3. Sun X, Sit A, Feinberg MW. Role of miR-181 family in regulating vascular inflammation and immunity. Trends Cardiovasc Med 2014; 24(3): 105–112. Dostupné z DOI: <http://dx.doi.org/10.1016/j.tcm.2013.09.002>.
4. Kumar S, Kim CW, Simmons RD et al. Role of flow-sensitive microRNAs in endothelial dysfunction and atherosclerosis: mechanosensitive athero-miRs. Arterioscler Thromb Vasc Biol 2014; 34(10): 2206–2216. Dostupné z DOI: <http://dx.doi.org/10.1161/ATVBAHA.114.303425>.
5. Davis-Dusenbery BN, Chan MC, Reno KE et al. down-regulation of Kruppel-like factor-4 (KLF4) by microRNA-143/145 is critical for modulation of vascular smooth muscle cell phenotype by transforming growth factor-beta and bone morphogenetic protein 4. J Biol Chem 2011; 286(32): 28097–28110. Dostupné z DOI: <http://dx.doi.org/10.1074/jbc.M111.236950>.
6. Taft RJ, Pang KC, Mercer TR et al. Non-coding RNAs: regulators of disease. J Pathol 2010; 220(2): 126–139. Dostupné z DOI: <http://dx.doi.org/10.1002/path.2638>.
7. Mattick JS. Non-coding RNAs: the architects of eukaryotic complexity. EMBO Rep 2001; 2(11): 986–991.
8. Djebali S, Davis CA, Merkel A et al. Landscape of transcription in human cells. Nature 2012; 489(7414): 101–108. Dostupné z DOI: <http://dx.doi.org/10.1038/nature11233>.
9. Hombach S, Kretz M. Non-coding RNAs: Classification, Biology and Functioning. Adv Exp Med Biol 2016; 937: 3–17. Dostupné z DOI: <http://dx.doi.org/10.1007/978–3-319–42059–2_1>.
10. Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell 2004; 116(2): 281–297.
11. Novák J, Olejníčková V, Tkáčová N et al. Mechanistic Role of MicroRNAs in Coupling Lipid Metabolism and Atherosclerosis. Adv Exp Med Biol 2015; 887: 79–100. Dostupné z DOI: <http://dx.doi.org10.1007/978–3-319–22380–3_5>. Erratum in Adv Exp Med Biol 2015; 888: E1-E2.
12. Creemers EE, Tijsen AJ, Pinto YM. Circulating MicroRNAs Novel Biomarkers and Extracellular Communicators in Cardiovascular Disease? Circ Res 2012; 110(3): 483–495. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCRESAHA.111.247452>.
13. van Rooij E, Olson EN. MicroRNA therapeutics for cardiovascular disease: opportunities and obstacles. Nat Rev Drug Discov 2012; 11(11): 860–872. Dostupné z DOI: <http://dx.doi.org/10.1038/nrd3864>.
14. Eberlé D, Hegarty B, Bossard P et al. SREBP transcription factors: master regulators of lipid homeostasis. Biochimie 2004; 86(11): 839–848.
15. Najafi-Shoushtari SH, Kristo F, Li Y et al. MicroRNA-33 and the SREBP host genes cooperate to control cholesterol homeostasis. Science 2010; 328(5985): 1566–1569. Dostupné z DOI: <http://dx.doi.org/10.1126/science.1189123>.
16. Allen RM, Marquart TJ, Albert CJ, et al. miR-33 controls the expression of biliary transporters, and mediates statin- and diet-induced hepatotoxicity. EMBO Mol Med 2012; 4(9): 882–895. Dostupné z DOI: <http://dx.doi.org/10.1002/emmm.201201228>.
17. Rayner KJ, Sheedy FJ, Esau CC et al. Antagonism of miR-33 in mice promotes reverse cholesterol transport and regression of atherosclerosis. J Clin Invest 2011; 121(7): 2921–2931. Dostupné z DOI: <http://dx.doi.org/10.1172/JCI57275>.
18. Rayner KJ, Esau CC, Hussain FN et al. Inhibition of miR-33a/b in non-human primates raises plasma HDL and lowers VLDL triglycerides. Nature 2011; 478(7369): 404–407. Dostupné z DOI: <http://dx.doi.org/10.1038/nature10486>.
19. Ouimet M, Ediriweera HN, Gundra UM et al. MicroRNA-33-dependent regulation of macrophage metabolism directs immune cell polarization in atherosclerosis. J Clin Invest 2015; 125(12): 4334–4348. Dostupné z DOI: <http://dx.doi.org/10.1172/JCI81676>.
20. Shirasaki T, Honda M, Shimakami T et al. MicroRNA-27a regulates lipid metabolism and inhibits hepatitis C virus replication in human hepatoma cells. J Virol 2013; 87(9): 5270–5286. Dostupné z DOI: <http://dx.doi.org/10.1128/JVI.03022–12>.
21. Vickers KC, Shoucri BM, Levin MG et al. MicroRNA-27b is a regulatory hub in lipid metabolism and is altered in dyslipidemia. Hepatol Baltim Md 2013; 57(2): 533–542. Dostupné z DOI: <http://dx.doi.org/10.1002/hep.25846>.
22. Vickers KC, Landstreet SR, Levin MG et al. MicroRNA-223 coordinates cholesterol homeostasis. Proc Natl Acad Sci U S A 2014; 111(40): 14518–14523. Dostupné z DOI: <http://dx.doi.org/10.1073/pnas.1215767111>.
23. Soh J, Iqbal J, Queiroz J et al. MicroRNA-30c reduces hyperlipidemia and atherosclerosis in mice by decreasing lipid synthesis and lipoprotein secretion. Nat Med 2013; 19(7): 892–900. Dostupné z DOI: <http://dx.doi.org/10.1038/nm.3200>.
24. Goedeke L, Rotllan N, Canfrán-Duque A et al. MicroRNA-148a regulates LDL receptor and ABCA1 expression to control circulating lipoprotein levels. Nat Med 2015; 21(11): 1280–1289. Dostupné z DOI: <http://dx.doi.org/10.1038/nm.3949>.
25. Tabet F, Vickers KC, Cuesta Torres LF et al. HDL-transferred microRNA-223 regulates ICAM-1 expression in endothelial cells. Nat Commun 2014; 5: 3292. Dostupné z DOI: <http://dx.doi.org/10.1038/ncomms4292>.
26. Suárez Y, Wang C, Manes TD et al. Cutting edge: TNF-induced microRNAs regulate TNF-induced expression of E-selectin and intercellular adhesion molecule-1 on human endothelial cells: feedback control of inflammation. J Immunol 2010; 184(1): 21–25. Dostupné z DOI: <http://dx.doi.org/10.4049/jimmunol.0902369>.
27. Jansen F, Yang X, Baumann K et al. Endothelial microparticles reduce ICAM-1 expression in a microRNA-222-dependent mechanism. J Cell Mol Med 2015; 19(9): 2202–2214. Dostupné z DOI: <http://dx.doi.org/10.1111/jcmm.12607>.
28. Harris TA, Yamakuchi M, Ferlito M et al. MicroRNA-126 regulates endothelial expression of vascular cell adhesion molecule 1. Proc Natl Acad Sci U S A 2008; 105(5): 1516–1521. Dostupné z DOI: <http://dx.doi.org/10.1073/pnas.0707493105>.
29. Sun X, He S, Wara AKM et al. Systemic delivery of microRNA-181b inhibits nuclear factor-κB activation, vascular inflammation, and atherosclerosis in apolipoprotein E-deficient mice. Circ Res 2014; 114(1): 32–40. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCRESAHA.113.302089>.
30. Cheng HS, Sivachandran N, Lau A et al. MicroRNA-146 represses endothelial activation by inhibiting pro-inflammatory pathways. EMBO Mol Med 2013; 5(7): 1017–1034. Dostupné z DOI: <http://dx.doi.org/10.1002/emmm.201202318>.
31. Zhou J, Li Y-S, Nguyen P et al. Regulation of vascular smooth muscle cell turnover by endothelial cell-secreted microRNA-126: role of shear stress. Circ Res 2013; 113(1): 40–51. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCRESAHA.113.280883>.
32. Hergenreider E, Heydt S, Tréguer K et al. Atheroprotective communication between endothelial cells and smooth muscle cells through miRNAs. Nat Cell Biol 2012; 14(3): 249–256. Dostupné z DOI: <http://dx.doi.org/10.1038/ncb2441>.
33. Boettger T, Beetz N, Kostin S et al. Acquisition of the contractile phenotype by murine arterial smooth muscle cells depends on the Mir143/145 gene cluster. J Clin Invest 2009; 119(9): 2634–2647. Dostupné z DOI: <http://dx.doi.org/10.1172/JCI38864>.
34. Lovren F, Pan Y, Quan A et al. MicroRNA-145 targeted therapy reduces atherosclerosis. Circulation 2012; 126(11 Suppl 1): S81–S90.
35. Chen X, Ba Y, Ma L et al. Characterization of microRNAs in serum: a novel class of biomarkers for diagnosis of cancer and other diseases. Cell Res 2008; 18(10): 997–1006. Dostupné z DOI: <http://dx.doi.org/10.1038/cr.2008.282>.
36. Xin Y, Yang C, Han Z. Circulating miR-499 as a potential biomarker for acute myocardial infarction. Ann Transl Med 2016; 4(7): 135. Dostupné z DOI: <http://dx.doi.org/10.21037/atm.2016.03.40>.
37. Lee EJ, Baek M, Gusev Y et al. Systematic evaluation of microRNA processing patterns in tissues, cell lines, and tumors. RNA 2008; 14(1): 35–42.
38. Heggermont WA, Heymans S. MicroRNAs Are Involved in End-Organ Damage During Hypertension. Hypertension 2012; 60(5): 1088–1093. Dostupné z DOI: <http://dx.doi.org/10.1161/HYPERTENSIONAHA.111.187104>.
39. Navickas R, Gal D, Laucevičius A et al. Identifying circulating microRNAs as biomarkers of cardiovascular disease: a systematic review. Cardiovasc Res 2016; 111(4): 322–337. Dostupné z DOI: <http://dx.doi.org/10.1093/cvr/cvw174>.
40. Zhang J-Y, Gong Y-L, Li C-J et al. Circulating MiRNA biomarkers serve as a fingerprint for diabetic atherosclerosis. Am J Transl Res 2016; 8(6): 2650–2658.
41. Volný O, Kašičková L, Coufalová D et al. microRNAs in Cerebrovascular Disease. Adv Exp Med Biol 2015; 888: 155–195. Dostupné z DOI: <http://dx.doi.org/10.1007/978–3-319–22671–2_9>.
42. Janssen HLA, Reesink HW, Lawitz EJ et al. Treatment of HCV infection by targeting microRNA. N Engl J Med 2013; 368(18): 1685–1694. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa120902>.
43. Duell PB, Santos RD, Kirwan BA et al. Long-term mipomersen treatment is associated with a reduction in cardiovascular events in patients with familial hypercholesterolemia. J Clin Lipidol 2016; 10(4): 1011–1021. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacl.2016.04.013>.
Štítky
Angiologie Diabetologie Interní lékařství Kardiologie Praktické lékařství pro dospěléČlánek vyšel v časopise
Athero Review

2016 Číslo 3
Nejčtenější v tomto čísle
- Arterin® – doplněk stravy v léčbě dyslipidemie: výsledky krátkodobého klinického sledování
- Aterogénna dyslipidémia – nový cieľ v kardiovaskulárnej prevencii
- Periférne artériové ochorenie dolných končatín a dyslipidémia
- Inhibítory proproteín konvertázy subtilizín/kexín typ 9 (PCSK9)



