Negativní metabolické působení antihypertenziv. Je to vůbec klinicky relevantní?
Adverse metabolic effects of antihypertensive drugs. Is it clinically relevant at all?
Adverse metabolic effects of antihypertensive drugs are mentioned in connection with the therapy using beta-blockers and/or diuretics. Both these main classes of antihypertensive drugs have an irreplaceable role to play in the therapy of arterial hypertension and they demonstrably reduce cardiovascular morbidity and mortality among hypertensive patients. On the other hand, they may induce, or rather precipitate the development of diabetes mellitus and dyslipidemia in predisposed individuals, as opposed to the therapy based on inhibitors of the renin-angiotensin system and/or calcium channel blockers. Differences continue to exist as to whether the adverse metabolic effect is so powerful to impact patients prognosis. Furthermore, each class contains a considerably heterogeneous group of drugs with different properties and their adverse metabolic effects thus cannot be generalized. This article summarizes some of the current findings on the effects of diuretics and beta-blockers on blood glucose and plasma lipid metabolism.
Key words:
adverse metabolic effects – diabetes mellitus – dyslipidemia – antihypertensive therapy – beta-blockers – diuretics
Authors:
Ondřej Petrák
Authors‘ workplace:
Centrum pro výzkum, diagnostiku a léčbu arteriální hypertenze III. Interní kliniky 1. LF UK A VFN v Praze
Published in:
AtheroRev 2016; 1(2): 74-79
Category:
Reviews
Overview
Metabolicky negativní působení antihypertenziv je zmiňováno v souvislosti s terapií betablokátory a/nebo diuretiky. Obě tyto hlavní třídy antihypertenziv mají nezastupitelné místo v terapii arteriální hypertenze a prokazatelně snižují kardiovaskulární morbiditu a mortalitu hypertoniků. Na druhou stranu u predisponovaných jedinců mohou navodit či spíše urychlit rozvoj diabetes mellitus a dyslipidemie ve srovnání s terapií založenou na inhibitorech systému renin-angiotenzinového a/nebo blokátorech kalciového kanálu. Nadále panují rozpory, zda je negativní metabolický efekt natolik významný, že zasáhne do prognózy nemocných. Navíc každá třída obsahuje značně heterogenní skupinu léků s rozdílnými vlastnostmi, a tak nelze jejich negativní metabolické působení paušalizovat. Tento článek sumarizuje některé současné poznatky o vlivu diuretik a betablokátorů na metabolizmus glukózy a plazmatických lipidů.
Klíčová slova:
negativní metabolické působení – diabetes mellitus – dyslipidemie – antihypertenzní terapie – betablokátory – diuretika
Úvod
Snížením krevního tlaku dosáhneme zásadního zlepšení kardiovaskulární (KV) prognózy každého pacienta s arteriální hypertenzí. Dlouhá léta platilo, že podstatná není ani tak volba antihypertenziva z hlavní třídy jako vlastní snížení krevního tlaku. V posledním desetiletí se stále častěji poukazuje na negativní metabolické působení některých tříd antihypertenziv, zejména betablokátorů a diuretik. Poslední evropská i česká doporučení pro diagnostiku a léčbu arteriální hypertenze dokonce upravila schéma vhodných kombinací a odsunula diuretika a zvláště betablokátory na „druhou kolej“ (schéma 1) [1]. Nabízí se tak řada otázek. Opravdu je metabolicky negativní efekt natolik významný, že zasáhne do prognózy nemocných? Je klinicky ospravedlnitelné vyvarovat se některé z hlavní skupiny antihypertenziv z metabolických důvodů? Jakých cílových skupin se to týká? Trvá negativní metabolické působení i v případě kombinace s metabolicky pozitivními léky, nebo se tento efekt vyruší? Nutno přiznat, že odpověď na tyto otázky není jednoduchá a některé nadále zůstávají nezodpovězené.

První velké studie z 90. let (CAPP, LIFE a ALLHAT) upozornily na nižší výskyt onemocnění diabetes mellitus ve skupině pacientů léčených inhibitory renin-angiotenzinového systému ve srovnání s konvenčními betablokátory či saluretiky (thiazidová nebo thiazidům podobná diuretika). Přesto důkazy, které máme k dispozici jak pro betablokátory, tak pro saluretika ve snížení KV-morbidity a KV-mortality byly a jsou natolik silné, že na jejich metabolické působení nebyl při výběru vhodného farmaka dlouho brán ohled. Vždyť relativní snížení KV-příhod je při léčbě hypertenze diuretiky a betablokátory stejně vyjádřeno jak u pacientů s normální glykemií, tak u nemocných s porušenou glykemií na lačno, a dokonce i u diabetiků. Avšak jak se portfolio antihypertenziv rozšiřovalo, začalo se na metabolické působení více poukazovat. Problém v hodnocení významnosti metabolických změn spočívá v jednoduché logice. Nově vzniklému onemocnění diabetes mellitus bude trvat dalších 10–15 let, než se rozvinou jeho KV-komplikace a žádná studie netrvá tak dlouho, aby mohla tento dopad sledovat. Většina současných studií je nastavena na průměrné 5leté sledování, a ukazuje tak vliv konkrétní terapie v relativně krátkém časovém horizontu. Na druhou stranu odpůrci metabolického působení antihypertenziv poukazují na to, že takový pacient je pod kontrolou lékařů, a nově vzniklý diabetes je tak časně intervenován, a nelze tak s určitostí říci, že mu lékově navozený diabetes zhorší dlouhodobou prognózu. Navíc se ve valné většině jedná o predisponované nemocné, kteří by dříve či později diabetem stejně onemocněli.
Nutno podotknout, že pokud máme léčit metabolicky rizikového hypertonika, tedy pacienta s nadváhou či obezitou, s malou fyzickou aktivitou, dyslipidemií, porušenou glukózovou tolerancí a máme možnost volit léčbu, kterou můžeme oddálit rozvoj diabetes mellitus, tak proč ji nevyužít. Jiná situace nastává v případě rezistentní hypertenze nebo přítomnosti komorbidit, jako je ICHS, u nichž se již použití betablokátorů či diuretik nevyhneme a do jejichž léčby jistě patří. Navíc i tyto lékové třídy jsou značně heterogenní a obsahují léky s rozdílnými farmakokinetickými a farmakodynamickými vlastnostmi, a tedy i rozdílným metabolickým působením.
Metaanalýza studií
V roce 2007 byla v Lancetu publikována metaanalýza 22 studií zahrnujících přes 140 000 pacientů, kteří v době randomizace netrpěli onemocněním diabetes mellitus [2]. Jednalo se o výběr studií s různými třídami antihypertenziv převážně u hypertoniků (17 studií). Cílem bylo zjistit výskyt nově vzniklého diabetes mellitus v průběhu sledování ve studii. Autoři popsali nejnižší incidenci nově diagnostikovaného diabetes mellitus u pacientů léčených inhibitory ACE a sartany, dále následovaly blokátory kalciového kanálu a placebo a poté betablokátory a diuretika. Graf ukazuje riziko rozvoje diabetu, pokud jako referenční soubor zvolíme diuretika. Metaanalýza má řadu problémů v interpretaci. Jednak většina studií neměla v designu sledování výskytu diabetes mellitus jako primární či sekundární cíl (vyjma ALPINE – Antihypertensive Treatment and Lipid Profile in a North of Sweden Efficacy Evaluation study, DREAM – Diabetes Reduction Assessment With Ramipril and Rosiglitazone Medication, VALUE – Valsartan Antihypertensive Long-term Use Evaluation a ASCOT – Anglo-Scandinavian Cardiac Outcomes Trial) a i samotná diagnostická kritéria diabetu byla v jednotlivých studiích rozdílná (dle glykemie na lačno, dle OGTT či jen z anamnézy). Tato práce však znovu otevřela diskusi o vhodné volbě antihypertenzní terapie s ohledem na metabolické působení.
![Metaanalýza 22 studií ukazuje pokles rizika rozvoje diabetu, pokud jako referenční soubor zvolíme diuretika [2]](https://pl-master.mdcdn.cz/media/image/cdfb3cfc428eb5bfebac1a7683d5c348.jpg?version=1537796939)
Jaký je metabolický efekt diuretik?
Předpokládá se několik možných faktorů, které mohou navodit hyperglykemii a inzulinorezistenci (schéma 2) [3]. Za nejvýznamnější se pokládá hypokalemie jako typický projev terapie saluretiky, která jednak může snižovat sekreci inzulinu z B-buněk pankreatu a zároveň zhoršovat utilizaci glukózy ve svalových buňkách, neboť omezuje vazodilataci periferního řečiště, a tím zvyšuje periferní cévní rezistenci [4]. Navíc v experimentálních studiích mohou thiazidy přímo nezávisle na hladině kalemie ovlivňovat kaliové kanály B-buněk pankreatu a navozovat hyperpolarizaci se snížením sekrece inzulinu [5].
![Schéma 2 | Předpokládané mechanizmy metabolického působení thiazidových diuretik vedoucí k hyperglykemii [3]](https://pl-master.mdcdn.cz/media/image/839b1da55b7a6371055800fcda9be303.jpg?version=1537794967)
Ve studii SHEP (Systolic Hypertension in the Elderly Program) – chlortalidon vs placebo u osob nad 60 let v terapii izolované systolické hypertenze – bylo mezi 3 790 účastníky v 1. roce studie každé snížení o 0,5 mmol/l kalemie nezávisle spojeno s 45% (95% CI, 24 %–70 %; p < 0,001) nárůstem adjustovaného rizika rozvoje diabetu [6]. Předpokládá se, že výraznější hypokalemie přítomná při léčbě chlortalidonem bránila ve studii SHEP příznivému účinku chlortalidonu na ICHS i cévní mozkové příhody. Ovšem po 1. roce již nedocházelo k rozdílům mezi chlortalidonem a placebem [6].
Rozsáhlá metaanalýza 83 studií z let 1966 až 2005 zahrnující přes 58 000 pacientů ukázala na úzký vztah mezi změnou kalemie navozenou thiazidy a vzestupem glykemie [7]. Vztah bylo možné vyjádřit zvýšením glykemie o 0,56 mmol/l při poklesu sérového kalia o 1 mmol/l. Důležité je také zjištění, že změny kalia a glykemie byly o 50 % menší v podskupinách studií, které používaly prevenci vzniku hypokalemie.
Diuretika také ovlivňují hladiny sérových lipidů, zřejmě v souvislosti se zhoršenou inzulinovou senzitivitou a/nebo reflexní aktivací systému renin-aldosteronového a sympatiku jako odezva na volumovou depleci. Aktivace sympatického nervového systému zvyšuje prostřednictvím beta-adrenergních receptorů lipolýzu a současná alfa-adrenergní vazokonstrikce navozuje hyperlipidemii.
Jaký je metabolický efekt betablokátorů?
V případě betablokátorů se podezřívají následující mechanizmy [8]:
- Betablokátory omezují časnou fázi a prodlužují pozdní fázi inzulinové sekrece vedoucí k hyperinzulinemii a inzulinové rezistenci
- Pokles průtoku svalovou tkání způsobený relativní převahou alfa-receptorů a následnou hyperglykemií při zhoršené utilizaci glukózy
- Terapie betablokátory navozuje vzestup tělesné hmotnosti s centrální kumulací tuku a inzulinovou rezistencí, která způsobuje i změny v sérových lipidech. Na vzestupu tělesné hmotnosti se může podílet i snížení bazální energetické potřeby navozené betablokátory
- Betablokátory snižují aktivitu lipoproteinové lipázy a LCAT (lecitin-cholesterol acyl transferázy), což vede k poklesu hladin HDL
Jakou máme evidenci pro negativní metabolické působení těchto léků?
Jednoduchá a zajímavá švédská studie ALPINE (Antihypertensive Treatment and Lipid Profile in the North of Sweden Efficacy Evaluation) sledovala metabolický vliv 1roční léčby kandesartanem v dávce 16 mg (± felodipin 2,5–5 mg) vs hydrochlorothiazid v dávce 25 mg (± atenolol 50–100 mg) u dosud neléčených 392 lehkých až středně těžkých hypertoniků bez diabetu [9]. Terapie založená na thiazidovém diuretiku a konvenčním betablokátoru v průběhu 1 roku ovlivňovala negativně metabolizmus glukózy a lipidů včetně vzestupu apolipoproteinu B ve srovnání s terapií založenou na sartanu v kombinaci s nondihydropyridinovým blokátorem kalciového kanálu.
Velká americká studie ALLHAT (Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial) sledovala efekt chlortalidonu, lisinoprilu a amlodipinu na výskyt kardiovaskulární morbidity a mortality u více než 33 000 hypertoniků starších 55 let s alespoň jedním dalším KV-rizikovým faktorem. Výskyt nově vzniklého diabetu byl častější ve skupině léčené chlortalidonem a po 4 letech léčby činil 11,6 %, zatímco v amlodipinové větvi činil 9,8 % a v lisinoprilové 8,1 % [10]. Podstatné je několik zjištění. Diabetes mellitus se vyskytl i u pacientů léčených inhibitorem ACE. Pokud srovnáme incidenci nově vzniklého diabetu s metabolicky neutrálním amlodipinem, lze konstatovat, že 83 % případů nově vzniklého diabetu při terapii chlortalidonem nemohlo být způsobeno tímto diuretikem. Dále incidence diabetu kulminovala pouze v prvních 2 letech léčby chlortalidonem a poté se už nelišila od dalších dvou skupin antihypertenziv.
Ze skupiny saluretik je jediný indapamid zmiňován jako metabolicky neutrální, tedy neovlivňující ani metabolizmus glukózy ani hladiny sérových lipidů v dávce 1,5 mg po dobu 52 týdnů [11]. Víme, že v malém souboru diabetiků s lehkou až středně těžkou hypertenzí léčba dávkou 2,5 mg indapamidu denně nezhoršovala glykemický profil, lipidogram a hladiny kyseliny močové po půlroční léčbě [12]. Ve studii NESTOR (Natrilix SR versus Enalapril Study in hypertensive Type 2 diabetics with micrOalbuminuRia) byl indapamid v dávce 1,5 mg SR srovnáván s enalaprilem v dávce 10 mg u 570 diabetiků 2. typu, přičemž po 1roční terapii oba léky významně snižovaly albuminurii. Indapamid však na konci studie vykazoval zhoršení hladin glykovaného hemoglobinu i glykemie na lačno, stejně jako trend k vyšším hladinám celkového cholesterolu a hyperurikemii ve srovnání s enalaprilem [13].
Diuretika ze skupiny kalium šetřících (amilorid, spironolakton a eplerenon) zřejmě nemají metabolicky negativní efekt.
V roce 2007 byla uveřejněna metaanalýza 12 studií čítající přes 94 000 pacientů, která sledovala rozvoj onemocnění diabetes mellitus (DM) u pacientů léčených betablokátorem jako lékem první volby, a to déle než 1 rok [14]. Autoři zjistili, že relativní riziko rozvoje DM je při terapii betablokátorem o 22 % vyšší než v případě jiného nediuretického antihypertenziva (RR 1,22; 95% CI 1,12–1,33). Při hodnocení metabolického vlivu betablokátorů (BB) je nutno si uvědomit, že se jedná o značně heterogenní skupinu zahrnující léky s velmi rozdílnou selektivitou k beta-adrenergním receptorům a odlišnými farmakokinetickými a farmakodynamickými vlastnostmi. Negativní metabolické působení tedy nelze extrapolovat na celou třídu BB. Bohužel, výše zmiňovaná metaanalýza srovnávala studie s atenololem, metoprololem a propranololem. Dnes již víme, že atenolol je BB zcela nevhodný k terapii arteriální hypertenze, nicméně ještě před 20 lety patřil k nejčastěji předepisovaným kardiologickým lékům. Bohužel atenolol se stal, možná i záměrně, velmi častým komparátorem s jinou studovanou antihypertenzní léčbou, a právem tak může být označen za lék, který zkazil reputaci celé skupině betablokátorů.
Studie LIFE (Losartan Intervention For Endpoint reduction) srovnávala působení losartanu vs atenololu u 9 193 hypertoniků s hypertrofií levé komory na KV-mortalitu, nefatální CMP a IM. Výskyt nově diagnostikovaného diabetu byl vyšší v atenololové skupině a tento trend byl zachován po celou dobu trvání studie i po jejím ukončení.
Jedna z posledních velkých studií ASCOT-BPLA (Anglo-Scandinavian Cardiac Outcomes Trial- -Blood Pressure Lowering Arm) sledovala na rozsáhlém souboru skoro 20 000 vysoce kardiovaskulárně rizikových hypertoniků vliv podávání amlodipinu ± perindopril vs atenololu ± thiazidové diuretikum (bendroflumethiazid). Není žádným překvapením, že z metabolického hlediska se jako nevýhodná ukázala kombinace atenololu a thiazidu, přičemž nově diagnostikovaný diabetes během studie činil ve skupině amlodipinové 8 %, zatímco v atenololové 11,4 % [15]. Relativní riziko rozvoje diabetu bylo vyšší o 31 % (HR 0,69, 95% CI 0,62–0,77) při terapii betablokátorem ve srovnání s blokátorem kalciového kanálu. Zvýšená hodnota glykemie na lačno byla nejvýraznějším prediktorem vzniku diabetu – vzestup o každý 1 mmol/l nad hodnotu 5 mmol/l zvyšoval riziko 5,8násobně. Z hlediska BMI lze konstatovat BMI, že na každých 5 jednotek vzestupu hodnoty BMI nad normu vzrůstalo riziko vzniku diabetu o 49 %. U hladiny triglyceridů vzrůstá riziko o 12 % na každý vzestup hladiny o 1 mmol/l nad horní hranici normy.
Kdo je tedy v riziku rozvoje lékově navozeného diabetes mellitus?
Jak vyplývá z výše uvedených skutečností, mezi faktory spojené s vyšším rizikem rozvoje onemocnění diabetes mellitus při terapii diuretiky/betablokátory patří vyšší body mass index, vyšší glykemie na lačno či porušená glukózová tolerance a sklon k hypokalemii.
Jaká je prognóza lékově navozeného diabetes mellitus?
Dostupné máme pouze 3 klinicko-epidemiologické studie.
Malá observační studie Verdecchia srovnávala KV-riziko nově vzniklého diabetu s rizikem již přítomným před začátkem sledování [16]. Celkem bylo sledováno 795 hypertoniků, z nichž 6,5 % mělo diagnostikovaný diabetes a po mediánu sledování 3 let byl diabetes nově diagnostikován u 5,8 %, přičemž nezávislými prediktory byla hladina glykemie na lačno a terapie diuretiky. Celkově malé početní zastoupení diabetiků je zároveň slabinou celé této práce. V průběhu dalšího 14letého sledování autoři popsali významné relativní riziko KV-komplikací u nemocných s již přítomným DM (3,57, p = 0,001), ale i nově vzniklým DM (2,92, p = 0,007) ve srovnání s pacienty bez diabetu.
Druhá studie Primary Prevention Trial neprokázala významně vyšší KV-riziko u nově vzniklého DM při sledování 686 švédských hypertoniků po dobu 15 let [17]. Během sledování zemřelo na ICHS nebo dostalo IM 133 pacientů. U 91 pacientů se rozvinul diabetes, což odpovídá 1roční incidenci 1,3 %. Diabetes přítomný na začátku studie vykazoval významné riziko vzniku ICHS (OR 2,12, 95% CI 1,11–4,67), zatímco v případě nově vzniklého DM nikoliv (OR 1,46, 95% CI 0,37–6,0, p = NS).
Studie SHEP sledovala v letech 1985 až 1991 vliv monoterapie chlortalidonem ve srovnání s placebem u izolované systolické hypertenze starších osob. V roce 2000 byla provedena extenze původní studie (SHEP-X) a byli vyšetřeni přeživší pacienti zařazení do studie [18]. Celková doba sledování tedy byla 14,3 let. Ve studii SHEP-X neovlivnil nově vzniklý DM ve skupině nemocných léčených chlortalidonem následné riziko kardiovaskulární ani celkové mortality narozdíl od nově vzniklého diabetu v placebové skupině, v níž bylo zvýšení rizika kardiovaskulární i celkové mortality významné. Tato studie SHEP-X poskytuje data s největší výpovědní hodnotou, jednalo se o velký soubor pacientů a studie měla nejmenší „kontaminaci“ jinými antihypertenzivy.
Jaké diuretikum a jaký betablokátor jsou tedy z metabolického hlediska nejvhodnější?
Odpověď ovšem není jednoduchá. V případě diuretik totiž neexistuje studie, která by přímo srovnávala jednotlivé léky mezi sebou. V loňském roce byla publikována metaanalýza srovnávající jejich účinnost a metabolické působení, přičemž chlortalidon a indapamid se ukázaly jako účinnější ve snížení krevního tlaku ve srovnání s hydrochlorothiazidem v ekvipotentních dávkách, ale překvapivě mezi léky nebyly shledány rozdíly v metabolickém působení [19].
Vztah mezi antihypertenzním účinkem hydrochlorothiazidu a dávkou je poměrně plochý, takže lze používat nízké dávky hydrochlorothiazidu 6,25–12,5 mg, které uspokojivě snižují krevní tlak a vedou méně často k hypokalemii. Kombinace malé dávky thiazidového diuretika s kalium šetřícím diuretikem může být z metabolického hlediska protektivní, a zamezovat tak do určité míry nežádoucímu efektu [20].
Studie STAR (Study od Trandolapril/verapamil SR And insulin Resistance) nám dala odpověď na otázku, zda kombinace inhibitoru ACEI/sartanu s thiazidovým diuretikem zruší negativní metabolický vliv [21]. Jednoroční prospektivní a randomizovaná studie u hypertoniků s metabolickým syndromem srovnávala vliv fixní kombinace 180 mg verapamilu SR s 2 mg trandolaprilu oproti fixní kombinaci 50 mg losartanu s 12,5 mg hydrochlorothiazidu na glukózovou toleranci (zjištěnou pomocí OGTT), inzulinovou senzitivitu a na vznik nového diabetu. Autoři zjistili nižší incidenci nově vzniklého diabetu při terapii trandolaprilem s verapamilem oproti losartanu s hydrochlorothiazidem (11 % vs 26,6 %, p = 0,002). Extenze této studie ukázala, že ukončení podávání diuretika vede k reverznímu efektu, a tedy ke zlepšení kontroly glykemie [22]. K obdobnému závěru došli i autoři studie OLAS s olmesartanem v kombinaci buď s amlodipinem nebo hydrochlorothiazidem [23].
Zajímavá by byla data ze studie ACCOMPLISH (Avoiding Cardiovascular Events in Combination Therapy in Patients Living with Systolic Hypertension) srovnávající benazepril ve fixní kombinaci s amlodipinem nebo hydrochlorothiazidem ve velkém souboru 11 506 vysoce KV-nemocných pacientů [24]. Složený kardiovaskulární primární cíl (úmrtí z KV-příčin, nefatální IM, nefatální CMP, hospitalizace pro anginu pectoris, úspěšná resuscitace pro srdeční zástavu a koronární revaskularizace) vyšel jednoznačně ve prospěch fixní kombinace benazeprilu s amodipinem s poklesem a až o 20 % (HR 0,80, 95% CI, 0,72–0,90; P < 0,001), přičemž tento trend byl zachován i při hodnocení všech podskupin včetně diabetiků, kterých bylo ve studii 60 % z celého souboru. Chybí však publikovaná data sledující zhoršení či zlepšení kontroly glykemie nebo incidenci nově vzniklého diabetu v této studii.
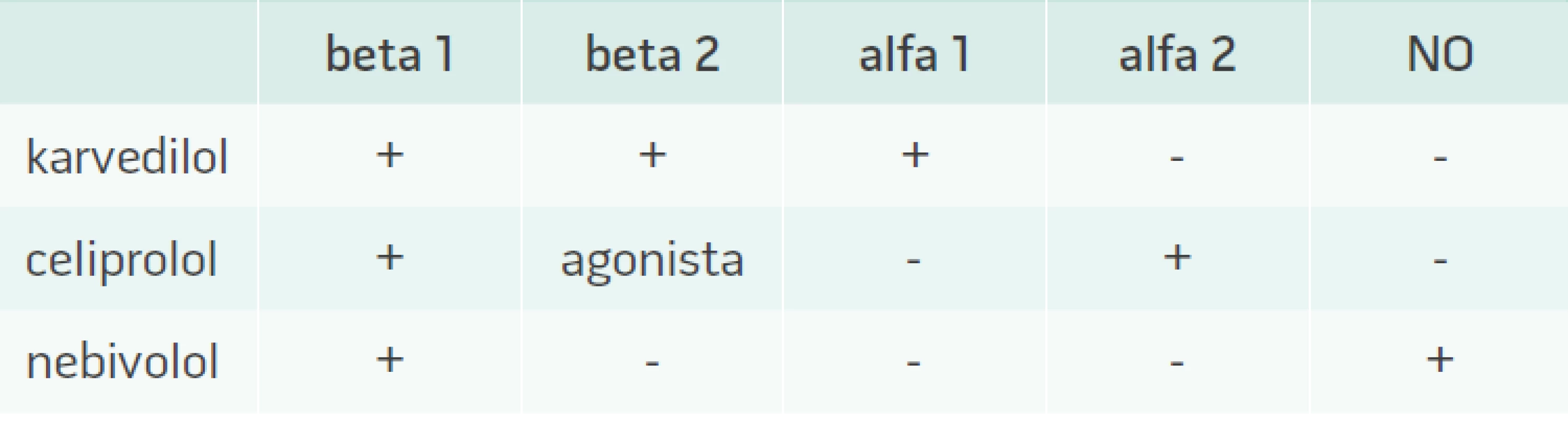
V případě betablokátorů nebyl metabolicky negativní efekt popsán u betablokátorů 3. generace, kam patří nebivolol, karvedilol a ceriprolol (tab. 1) [25,26]. Ty mají vyjma sympatolytického účinku i aditivní vazodilatační a často i antioxidační efekt, jenž působí neutrálně na metabolizmus glukózy a lipidů. Podávání těchto léků u metabolicky rizikových nemocných lze ve srovnání s konvenčními betablokátory starší generace považovat za bezpečné. Jistou nevýhodou této skupiny je malé množství důkazů z morbiditních a mortalitních studií u pacientů s arteriální hypertenzí.
Závěr
V názvu článku je položena otázka, zda je negativní metabolické působení antihypertenziv klinicky relevantní. Na tuto otázku lze odpovědět kladně, ale pouze u metabolicky rizikových nemocných, tedy pacientů obézních s porušenou glukózovou tolerancí či jinými projevy metabolického syndromu. U těchto nemocných je vhodné v terapii hypertenze preferovat nejprve inhibitory ACE či sartany jako léky první volby, eventuálně jejich kombinaci s blokátory kalciového kanálu. Pokud se jedná o diuretika a jejich metabolický efekt, lze konstatovat, že všechna saluretika zřejmě mají diabetogenní potenciál daný jejich komplexním působením, přičemž nejvýznamnější roli zde hraje hypokalemie. Při léčbě je tedy vhodné začínat nižší dávkou saluretika nejlépe ve fixní kombinaci s kalium šetřícím diuretikem a mineralogram pravidelně kontrolovat. V danou chvíli máme nejméně rozporuplných dat pro indapamid, který je považován spíše za metabolicky neutrální. Z hlediska účinnosti léčby je lépe preferovat chlortalidon a indapamid oproti hydrochlorothiazidu. U rezistentní hypertenze může být přínosem podání spironolaktonu, který je metabolicky neutrální. V případě betablokátorů nebyl metabolicky negativní efekt popsán u betablokátorů 3. generace, mezi které patří nebivolol, karvedilol a ceriprolol. Z hlediska adherence k terapii je v indikaci antihypertenzní léčby lepší volit spíše nebivolol, neboť je hydrofilní, a nemá tak centrální nežádoucí účinky neselektivního karvedilolu (ospalost, únava, depresivní ladění) – souhrn účinků viz tab. 2.

Podpořeno grantem AZV 16–30345A
MUDr. Ondřej Petrák, Ph.D.
ondrej.petrak@vfn.cz
Centrum pro výzkum, diagnostiku a léčbu arteriální hypertenze III. Interní kliniky 1. LF UK a VFN v Praze
www.vfn.cz
Doručeno do redakce 18. 4. 2016
Přijato po recenzi 5. 5. 2016
Sources
1. Mancia G, Fagard R, Narkiewicz K et al. 2013 ESH/ESC Guidelines for the management of arterial hypertension: the Task Force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). J Hypertens 2013; 31(7): 1281–1357.
2. Elliott WJ, Meyer PM. Incident diabetes in clinical trials of antihypertensive drugs: a network meta-analysis. Lancet 2007; 369(9557): 201–207.
3. Duarte JD, Cooper-DeHoff RM. Mechanisms for blood pressure lowering and metabolic effects of thiazide and thiazide-like diuretics. Expert Rev Cardiovasc Ther 2010; 8(6): 793–802.
4. Agarwal R. Hypertension, hypokalemia, and thiazide-induced diabetes: a 3-way connection. Hypertension 2008; 52(6): 1012–1013.
5. Pickkers P, Schachter M, Hughes AD et al. Thiazide-induced hyperglycaemia: a role for calcium-activated potassium channels? Diabetologia 1996; 39(7): 861–864.
6. Shafi T, Appel LJ, Miller ER et al. Changes in serum potassium mediate thiazide-induced diabetes. Hypertension 2008; 52(6): 1022–1029.
7. Zillich AJ, Garg J, Basu S et al. Thiazide diuretics, potassium, and the development of diabetes: a quantitative review. Hypertension 2006; 48(2): 219–224.
8. Deshmukh M, Lee HW, McFarlane SI et al. Antihypertensive medications and their effects on lipid metabolism. Curr Diab Rep 2008; 8(3): 214–220.
9. Lindholm LH, Persson M, Alaupovic P et al. Metabolic outcome during 1 year in newly detected hypertensives: results of the Antihypertensive Treatment and Lipid Profile in a North of Sweden Efficacy Evaluation (ALPINE study). J Hypertens 2003; 21(8): 1563–1574.
10. ALLHAT Officers and Coordinators for the ALLHAT Collaborative Research Group. The Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial. Major outcomes in high-risk hypertensive patients randomized to angiotensin-converting enzyme inhibitor or calcium channel blocker vs diuretic: The Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial (ALLHAT). JAMA 2002; 288(23): 2981–2997. Erratum in JAMA 2004; 291(18): 2196. JAMA 2003; 289(2): 178.
11. Weidmann P. Metabolic profile of indapamide sustained-release in patients with hypertension: data from three randomised double-blind studies. Drug Saf 2001; 24(15): 1155–1165.
12. Raggi U, Palumbo P, Moro B et al. Indapamide in the treatment of hypertension in non-insulin-dependent diabetes. Hypertension 1985; 7(6 Pt 2): II157-II160.
13. Marre M, Puig JG, Kokot F et al. Equivalence of indapamide SR and enalapril on microalbuminuria reduction in hypertensive patients with type 2 diabetes: the NESTOR Study. J Hypertens 2004; 22(8): 1613–1622.
14. Bangalore S, Parkar S, Grossman E et al. A meta-analysis of 94,492 patients with hypertension treated with beta blockers to determine the risk of new-onset diabetes mellitus. Am J Cardiol 2007; 100(8): 1254–1262.
15. Gupta AK, Dahlof B, Dobson J et al. Determinants of new-onset diabetes among 19,257 hypertensive patients randomized in the Anglo-Scandinavian Cardiac Outcomes Trial--Blood Pressure Lowering Arm and the relative influence of antihypertensive medication. Diabetes Care 2008; 31(5): 982–988.
16. Verdecchia P, Reboldi G, Angeli F et al. Adverse prognostic significance of new diabetes in treated hypertensive subjects. Hypertension 2004; 43(5): 963–969.
17. Samuelsson O, Hedner T, Berglund G et al. Diabetes mellitus in treated hypertension: incidence, predictive factors and the impact of non-selective beta-blockers and thiazide diuretics during 15 years treatment of middle-aged hypertensive men in the Primary Prevention Trial Goteborg, Sweden. J Hum Hypertens 1994; 8(4): 257–263.
18. Kostis JB, Wilson AC, Freudenberger RS et al. Long-term effect of diuretic-based therapy on fatal outcomes in subjects with isolated systolic hypertension with and without diabetes. Am J Cardiol 2005; 95(1): 29–35.
19. Roush GC, Ernst ME, Kostis JB et al. Head-to-head comparisons of hydrochlorothiazide with indapamide and chlorthalidone: antihypertensive and metabolic effects. Hypertension 2015; 65(5): 1041–1046.
20. Jeunemaitre X, Charru A, Chatellier G et al. Long-term metabolic effects of spironolactone and thiazides combined with potassium-sparing agents for treatment of essential hypertension. Am J Cardiol 1988; 62(16): 1072–1077.
21. Bakris G, Molitch M, Hewkin A et al. Differences in glucose tolerance between fixed-dose antihypertensive drug combinations in people with metabolic syndrome. Diabetes Care 2006; 29(12): 2592–2597.
22. Bakris G, Molitch M, Zhou Q et al. Reversal of diuretic-associated impaired glucose tolerance and new-onset diabetes: results of the STAR-LET study. J Cardiometab Syndr 2008; 3(1): 18–25.
23. Martinez-Martin FJ, Rodriguez-Rosas H, Peiro-Martinez I et al. Olmesartan/amlodipine vs olmesartan/hydrochlorothiazide in hypertensive patients with metabolic syndrome: the OLAS study. J Hum Hypertens 2011; 25 (6): 346–353.
24. Jamerson K, Weber MA, Bakris GL et al. Benazepril plus amlodipine or hydrochlorothiazide for hypertension in high-risk patients. N Engl J Med 2008; 359(23): 2417–2428.
25. Toblli JE, DiGennaro F, Giani JF et al. Nebivolol: impact on cardiac and endothelial function and clinical utility. Vasc Health Risk Manag 2012; 8: 151–60.
26. Leonetti G, Egan CG. Use of carvedilol in hypertension: an update. Vasc Health Risk Manag 2012; 8: 307–322.
Labels
Angiology Diabetology Internal medicine Cardiology General practitioner for adultsArticle was published in
Athero Review

2016 Issue 2
Most read in this issue
- Monoklonálne protilátky v internej medicíne
- Diabetes mellitus a metabolizmus lipidov
- Alirokumab (Praluent®) ve světle studií
- LDL-cholesterol – hlavný rizikový faktor aterosklerózy
